Перейти к:
Динамика уровней лёгких и тяжёлых цепей нейрофиламентов в сыворотке крови детей со спинальной мышечной атрофией на фоне применения генной терапии
https://doi.org/10.46563/2686-8997-2025-6-1-26-36
EDN: usswzn
Аннотация
Введение. Определение уровней нейрофиламентов (НФ) в сыворотке крови детей с СМА может являться биомаркером тяжести и течения заболевания, а также способом оценки эффективности проведённой патогенетической терапии.
Цель исследования — определить уровни НФ в сыворотке крови детей в возрасте 0–24 мес с СМА I типа и на пресимптоматической стадии заболевания до и после проведения генной терапии препаратом онасемноген абепарвовек (ОА).
Материалы и методы. В исследование были включены 155 детей в возрасте 0–24 мес — 76 неврологически здоровых детей (группа II), а также 79 пациентов с СМА из группы I: подгруппа Ia — 44 ребёнка с СМА I типа, Ib — 35 детей на пресимптоматической стадии заболевания. У большинства детей с подгруппы Ia (n = 43; 97,7%) было 2 копии гена SMN2, в то время как у детей подгруппы Ib (n = 31; 88,6%) — 3 копии.
Результаты. Получены значения лёгких и тяжёлых цепей НФ у детей из группы I до и через 3–6, 7–12 и 13–24 мес после проведения генной терапии ОА. Уровень лёгких цепей НФ в подгруппе Ia до лечения был достоверно выше, чем в подгруппе Ib (p < 0,001) и в группе контроля (p < 0,001). Уровень тяжёлых цепей НФ в подгруппе Ia до лечения был достоверно выше, чем в группе контроля. В подгруппе Ia отмечено достоверное (р < 0,01) снижение уровней лёгких цепей НФ в сыворотке крови через 3–6 мес после проведения генной терапии (Me [Q1; Q3] — 22,97 [6,00; 48,54]) по сравнению с показателями до лечения (6,0 [5,92; 7,78]). Через 7–12 мес (6,15 [5,15– 7,30]) и 13–24 мес (6,0 [5,7–6,6]) отмечена стабилизация показателей медианы с уменьшением интерквартильных размахов. В подгруппе Ib также отмечено достоверное (р < 0,01) снижение уровней лёгких цепей НФ в сыворотке крови через 3–6 мес после проведения генной терапии ОА (6,0 [6,00; 7,25]) по сравнению с показателями до лечения (6,0 [6,00; 31,43]).
Заключение. Определение уровней лёгких и тяжёлых цепей НФ в сыворотке крови у пациентов с СМА до и после проведения генной терапии ОА может расцениваться как маркер тяжести заболевания и эффективности лечения.
Соблюдение этических стандартов. На проведение данного исследования было получено разрешение локального этического комитета ФГАУ «Национальный медицинский исследовательский центр здоровья детей» Минздрава России (протокол заседания ЛЭК № 10 от 06.10.2022).
Участие авторов:
Фисенко Д.А. — концепция и дизайн статьи, написание текста, редактирование;
Кузенкова Л.М. — концепция и дизайн статьи, написание текста, редактирование;
Куренков А.Л. — концепция и дизайн статьи, редактирование;
Семикина Е.Л. — редактирование;
Увакина Е.В. — концепция и дизайн статьи, написание текста, редактирование;
Черников В.В. — статистическая обработка данных;
Курбатова О.В. — редактирование;
Комягина Т.М. — редактирование;
Коняшин М.В. — редактирование;
Попович С.Г. — редактирование.
Все соавторы — утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Финансирование. Исследование не имело спонсорской поддержки.
Поступила 20.03.2025
Принята к печати 07.04.2025
Опубликована 30.04.2025
Ключевые слова
Для цитирования:
Фисенко Д.А., Кузенкова Л.М., Куренков А.Л., Семикина Е.Л., Увакина Е.В., Черников В.В., Курбатова О.В., Комягина Т.М., Коняшин М.В., Попович С.Г. Динамика уровней лёгких и тяжёлых цепей нейрофиламентов в сыворотке крови детей со спинальной мышечной атрофией на фоне применения генной терапии. Неврологический журнал имени Л.О. Бадаляна. 2025;6(1):26-36. https://doi.org/10.46563/2686-8997-2025-6-1-26-36. EDN: usswzn
For citation:
Fisenko D.A., Kuzenkova L.M., Kurenkov A.L., Semikina E.L., Uvakina E.V., Chernikov V.V., Kurbatova O.V., Komyagina T.M., Konyashin M.V., Popovich S.G. Trend in blood serum levels of light and heavy chains of neurofilaments in infants with spinal muscular atrophy against background of the use of gene therapy. L.O. Badalyan Neurological Journal. 2025;6(1):26-36. (In Russ.) https://doi.org/10.46563/2686-8997-2025-6-1-26-36. EDN: usswzn
Введение
Появление патогенетической/генной терапии спинальной мышечной атрофии (СМА) и внедрение расширенного неонатального скрининга на всей территории России обусловили значительные успехи в лечении данной патологии. Инструментальные и биохимические методы оценки эффективности патогенетической терапии СМА находятся в стадии изучения. В качестве потенциальных биомаркеров заболеваний, характеризующих повреждение и дегенерацию аксонов, к которым в том числе относится СМА, рассматриваются белки нейрофиламентов (НФ).
Белки НФ — нейронспецифические компоненты цитоскелета, которые различаются по относительной молекулярной массе. Крупнейшей из них является тяжёлая цепь НФ (200 кДа), за которой в порядке убывания молекулярной массы следуют средняя цепь (150 кДа), лёгкая цепь (70 кДа), α-интернексин (66 кДа) и периферин (57 кДа) [1, 2]. Роль НФ в нейронах до конца не изучена. НФ являются преимущественно аксональными структурными компонентами, участвуют в нейрональной проводимости, способствуют росту и стабильности аксонов как в центральных, так и в периферических нервах, а также поддерживают стабильность митохондрий содержимого микротрубочек [3]. При аксональном повреждении и гибели нейронов белки НФ высвобождаются в спинномозговую жидкость и дренируются в кровоток через арахноидальные грануляции в измеримых количествах [4]. Полученные достоверные корреляции между концентрациями НФ в плазме и ликворе позволили расширить спектр исследований НФ за счёт малоинвазивной и доступной процедуры забора крови по сравнению с диагностической люмбальной пункцией [5–9]. В исследованиях наибольшую значимость в качестве диагностических и прогностических маркеров получили лёгкие и тяжёлые цепи НФ [10–15].
Для измерения уровней белков НФ применяются количественные методы иммуноферментного анализа (ИФА): стандартный ИФА (sELISA), иммунополимеразная цепная реакция (иммуноколичественный ИФА или IQELISA) и высокочувствительный ИФА (SIMOA). Все методы различаются по используемым субстратам, способам обнаружения, чувствительности и объёмам образцов [16]. Основным преимуществом sELISA является наличие доступных наборов, позволяющих измерять множество различных белков; sELISA не требует специальной подготовки специалистов, позволяет легко интерпретировать данные и использует считыватель микропланшетов, совместимый с другими методами анализа. Эти преимущества привели к широкому использованию sELISA в научных исследованиях.
При IQELISA антитела для захвата наносятся на пластиковую 96-луночную пластину для полимеразной цепной реакции (ПЦР), в то время как обнаруживаемое антитело конъюгируется с уникальным штрих-кодом ДНК. Для проведения IQELISA используется небольшой объём исследуемого материала (~10 мкл). Однако по сравнению с sELISA, проведение метода IQELISA технически более сложное и для повышения достоверности полученных результатов требуется проведение исследования минимум в 3 пробах [16, 17].
Метод SIMOA — сверхчувствительный метод ИФА для количественного определения белковых биомаркеров с высокой точностью и производительностью, который использует гранулы, покрытые антителами, и флуоресцентно конъюгированные антитела для их обнаружения. Ключевым преимуществом SIMOA является то, что он может обнаруживать белки в фемтомолярном диапазоне [18]. Несмотря на то, что SIMOA обеспечивает самую высокую чувствительность из трех рассмотренных методов, у этой технологии есть ряд недостатков: количество белков, анализируемых с помощью этой технологии, составляет менее 200; прибор и наборы SIMOA не совместимы с другими видами ИФА, метод является дорогостоящим и требующим специальной подготовки [16].
С появлением методов определения НФ наблюдается увеличение количества исследований уровней НФ у пациентов при различных неврологических заболеваниях [5, 9, 19–21].
Белки НФ исследуются у пациентов с СМА, рассеянным склерозом, болезнями Альцгеймера и Паркинсона, Шарко–Мари–Тута, боковым амиотрофическим склерозом и лейкоэнцефалопатией у взрослых с аксональными сфероидами и пигментированной глией, а также при тяжёлых перинатальных повреждениях центральной нервной системы, асфиксии, неонатальных судорогах и др. [2, 6, 7, 19, 22–30].
Одной из актуальных проблем при исследовании уровней НФ является определение их референсных значений, поиск зависимостей от пола и возраста, наличия сопутствующей патологии и т. д. При анализе статей, посвящённых определению уровней НФ у пациентов с неврологической патологией, установлено, что в большинстве работ сравнение исследуемой группы проводилось не с группой нормы, а с группой контроля, в которую были включены индивиды без «неврологической симптоматики, острых/хронических воспалительных процессов, аутоиммунных заболеваний» в широком возрастном диапазоне; при этом показатели группы контроля варьировали и при статистическом анализе в ряде случаев не подчинялись гауссовскому распределению [2, 5, 18–21, 24, 31]. Поскольку на сегодняшний день существуют три основных метода определения уровней НФ, значения показателей в контрольных группах, установленных различными методами, не подлежат прямому сравнению. Вышеуказанные факторы объясняют отсутствие нормативных значений уровней НФ в реальной клинической практике.
Ряд авторов отмечают, что у пациентов с неврологической патологией изменение показателей уровней НФ в динамике является более значимым прогностическим фактором, чем сравнение с показателями контрольных групп [2, 32–35]. Доказано, что при нейрональном повреждении уровень НФ в ликворе и крови повышается [28, 36–38].
Ряд работ посвящён исследованию уровней НФ у детей с СМА. B.T. Darras и соавт. отметили, что у участников исследования ENDEAR (13-месячное многоцентровое рандомизированное плацебо-контролируемое исследование препарата нусинерсен у младенцев с инфантильным началом СМА) медиана исходного уровня тяжёлых цепей НФ (15 400 пг/мл; 2390–50 100; n = 117) была примерно в 10 раз выше, чем у детей того же возраста без СМА (р < 0,0001) [39].
У пациентов с СМА после проведения патогенетической терапии препаратом нусинерсеном уровень НФ в плазме крови снизился на 90,1% за 10 мес. У больных с СМА, вошедших в группу плацебо, несмотря на отсутствие патогенетического лечения, также произошло снижение уровней НФ (60,3% за 10 мес), что позволило авторам сделать вывод о том, что процессы нейродегенерации наиболее активны в дебюте заболевания [39].
С.R.R. Alves и соавт. при исследовании НФ в сыворотке крови и ликворе у детей с СМА отметили, что повышение уровней тяжёлых и лёгких цепей НФ обратно пропорционально количеству копий гена SMN2 [40]. При анализе различных вариантов патогенетической терапии детей с СМА авторы установили, что у детей, получавших монотерапию онасемногеном абепарвовеком (ОА), наблюдалось начальное резкое повышение уровня НФ в крови, тогда как у пациентов, получивших ОА после предварительной терапии нусинерсеном, подъёма уровней НФ в сыворотке крови не отмечалось. Данный феномен C.R.R. Alves и соавт. (2021) объяснили защитным эффектом предшествующей терапии нусинерсеном. Спустя некоторое время после введения ОА уровни НФ в сыворотке крови также снижались [40, 41]. Таким образом, несмотря на неоднозначность данных литературы, определение уровней НФ в сыворотке крови и ликворе может является перспективным биомаркером заболевания, а также способом оценки эффективности патогенетической терапии СМА.
Цель исследования — определить уровни НФ в сыворотке крови детей в возрасте 0–24 мес с СМА I типа и на пресимптоматической стадии заболевания до и после проведения генной терапии ОА.
Материалы и методы
В основную группу (I) были включены 79 детей со СМА. Диагноз был верифицирован при проведении молекулярно-генетического исследования, у всех детей была выявлена делеция экзонов 7 или 7–8 гена SMN1 в гомозиготном состоянии. Все пациенты получили генную терапию препаратом ОА, средний возраст на момент проведения терапии составил 2,90 ± 1,74 мес (95% ДИ 2,51–3,29), min — 1,00, max — 7,00.
Дети были распределены на 2 подгруппы в зависимости от наличия или отсутствия у них симптомов СМА на момент включения в исследование. В подгруппу Ia включены 44 ребёнка (22 (50,0%) мальчика и 22 (50,0%) девочки) с инфантильным дебютом СМА 1 типа). У абсолютного большинства пациентов подгруппы Ia было 2 копии гена SMN2 — 43 (97,7%), у 1 (2,3%) пациента — 3 копии. Возраст дебюта клинических симптомов в подгруппе Ia составил 1,15 ± 1,10 мес (95% ДИ 0,81–1,49), min — с рождения, max — 4,5 мес.
В подгруппу Ib вошли 35 детей (20 (57,1%) мальчиков и 15 (42,9%) девочек) с СМА на пресимптоматической стадии. У абсолютного большинства пациентов подгруппы Ib было 3 копии гена SMN2 — 31 (88,6%), у 4 (11,4%) — 2 копии.
В группу контроля были включены 76 неврологически здоровых детей в возрасте 0–24 мес: до 1 мес — 24 (31,6%), 1–6 мес — 18 (23,7%), 7–12 мес — 18 (23,7%), 13–24 мес — 16 (21%).
У всех детей с СМА уровни лёгких и тяжёлых цепей НФ были исследованы методом ИФА. Забор крови для исследования осуществлялся в строго ограниченном количестве из периферических вен, после оценки соматического статуса ребенка, а также с учётом массы тела пациента. Забор проводился только после получения информированного согласия родителей/законных представителей ребенка.
Уровни нейрофиламентов в сыворотке крови исследовали методом ИФА с применением следующих наборов реактивов: для определения протеина НФ 68 кДa (лёгкие цепи НФ) — «ELISA Kit for Neurofilament, Light Polypeptide (NEFL)»; протеина нейрофиламента 200 кДa (тяжёлые цепи НФ) — «ELISA Kit for Neurofilament, Heavy Polypeptide (NEFH)» («Cloud-Clone Corp») с использованием оборудования «Tecan Austria Sunrise» и «Tecan Austria HydroFlex» («Tecan»).
Статистический анализ проводили с использованием программы «StatTech v. 4.8.0» («Статтех»).
Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50).
Количественные показатели, выборочное распределение которых соответствовало нормальному, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD). В качестве меры репрезентативности для средних значений указывали границы 95% доверительного интервала (ДИ). В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей [Q1; Q3]. Категориальные данные описывали с указанием абсолютных значений (n) и долей (%). Сравнение двух групп по количественному показателю, распределение которого в каждой из групп соответствовало нормальному, при неравных дисперсиях выполняли с помощью t-критерия Уэлча. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна–Уитни. Сравнение 3 и более групп по количественному показателю, распределение которого в каждой из групп соответствовало нормальному, выполняли с помощью однофакторного дисперсионного анализа, апостериорные сравнения проводили с помощью критерия Тьюки (при условии равенства дисперсий), критерия Геймса–Хауэлла (при неравных дисперсиях). Сравнение 3 и более групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью критерия Краскела–Уоллиса, апостериорные сравнения — с помощью критерия Данна с поправкой Холма. В связи с тем, что значения большинства показателей не подчинялись нормальному распределению, направление и тесноту корреляционной связи между двумя количественными показателями оценивали с помощью коэффициента ранговой корреляции Спирмена. Коэффициент корреляции интерпретировали по шкале Чеддока: 0,1–0,3 — слабый; 0,3–0,5 — умеренный; 0,5–0,7 — заметный; более 0,7 — высокий. Различия считали статистически значимыми при p < 0,05.
Результаты
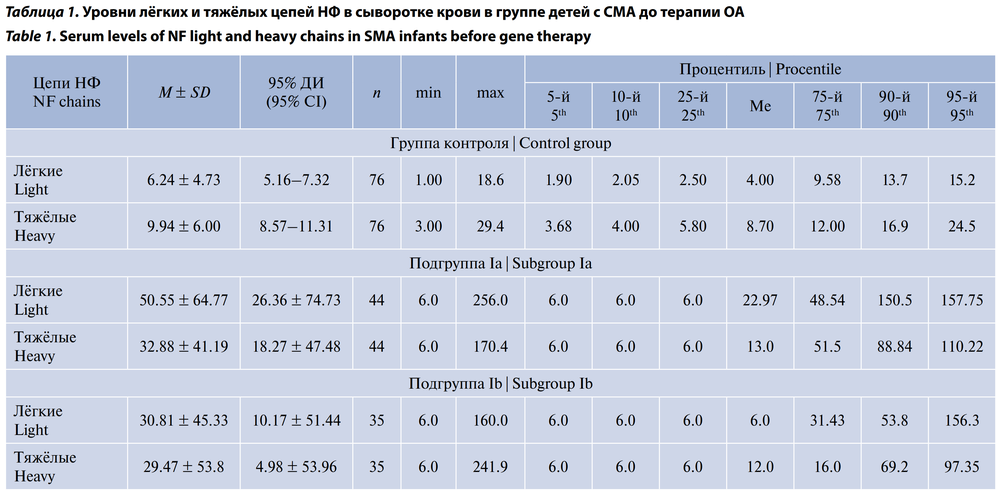
При исследовании уровней лёгких и тяжёлых цепей НФ в сыворотке крови в группе контроля и в основной группе полученные показатели не подчинялись гауссовскому распределению и описывались с помощью непараметрических методов: медианы (Me), процентилей (от 5-го до 95-го), минимума и максимума. В табл. 1 отражены статистические характеристики лёгких и тяжёлых цепей НФ в сыворотке крови в группе детей с СМА до терапии ОА.
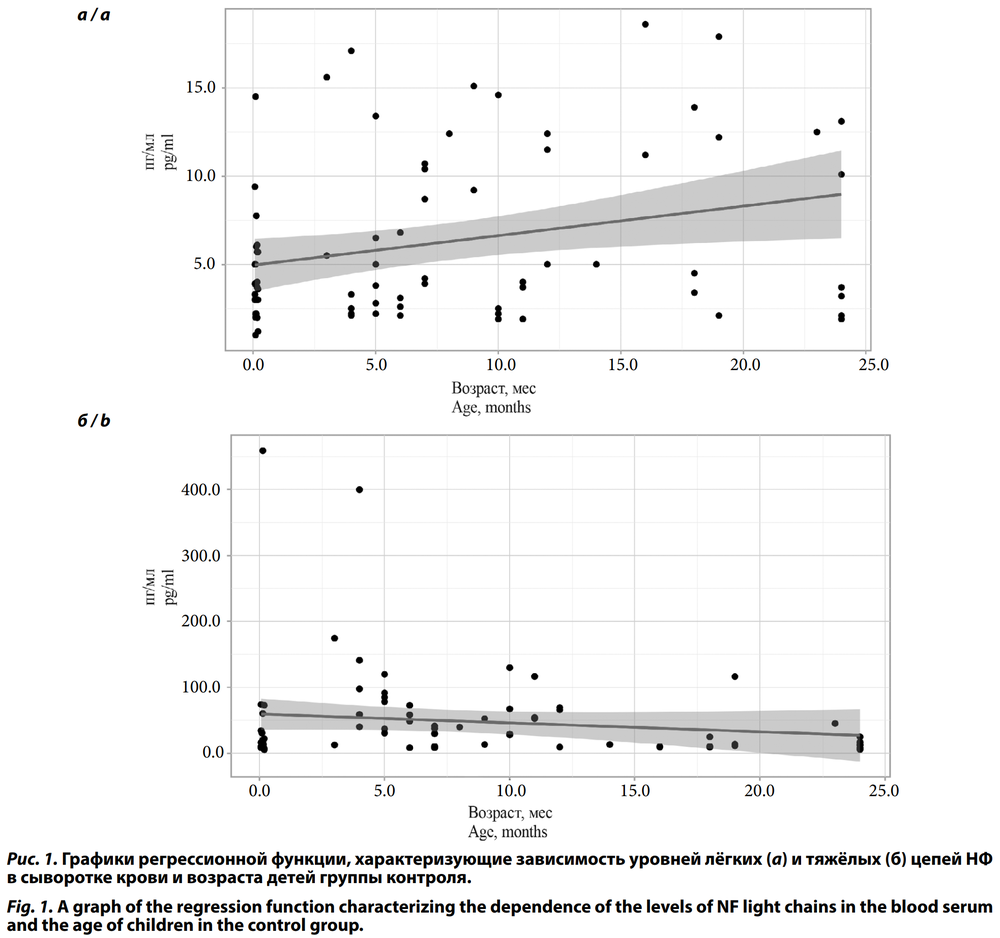
В дальнейшем внутри группы контроля был проведён корреляционный анализ зависимости уровней лёгких и тяжёлых цепей НФ в сыворотке крови от возраста детей — с 0 до 24 мес (рис. 1) и установлена незначимая слабой тесноты прямая связь (р = 0,07 и р = 0,14 соответственно). С учётом отсутствия значимой корреляционной связи между возрастом детей и уровнями лёгких и тяжёлых цепей НФ в сыворотке крови показатели группы контроля использовались в дальнейшей обработке данных исследования без разделения на возрастные категории.
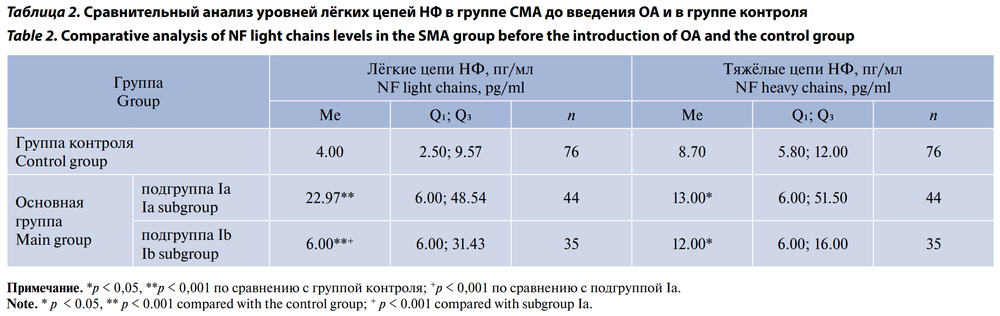
Уровень лёгких цепей НФ в подгруппе Iа до лечения был достоверно выше, чем в подгруппе Ib и в группе контроля (табл. 2), уровень тяжёлых цепей НФ в подгруппе Iа до лечения также был достоверно выше, чем в группе контроля (табл. 2). Значимых различий уровней лёгких и тяжёлых цепей НФ в сыворотке крови между подгруппой Ib до генной терапии и группой контроля не выявлено.
В подгруппе Ia отмечено достоверное снижение (р < 0,01) уровней лёгких цепей НФ в сыворотке крови через 3–6 мес после проведения генной терапии ОА (Ме = 22,97 [6,00; 48,54]) по сравнению с данными показателями до лечения (Ме = 6,0 [5,92; 7,78]). Через 7–12 мес (Ме = 6,15 [5,15; 7,30]) и 13–24 мес (Ме = 6,0 [5,7; 6,6]) отмечена стабилизация показателей Ме с уменьшением интерквартильных размахов (рис. 2, а). На рис. 2, б проиллюстрирована динамика средних значений уровней лёгких цепей НФ в сыворотке крови в подгруппе Iа: через 3–6 мес после проведения генной терапии отмечено резкое снижение показателей, через 7–12 мес и 13–24 мес — более плавное снижение.

В подгруппе Ib отмечено достоверное снижение (р < 0,01) уровней лёгких цепей НФ в сыворотке крови через 3–6 мес после проведения генной терапии (Ме = 6,0 [6,00; 7,25]) по сравнению с уровнями лёгких цепей НФ до лечения (Ме = 6,0 [6,00; 31,43]) за счёт уменьшения интерквартильных размахов при одинаковом уровне Ме (рис. 2). Через 7–12 (Ме = 6,0 [5,00; 6,00]) и 13–24 (Ме = 6,0 [5,00; 6,00]) мес после проведения генной терапии ОА продолжено снижение интерквартильных размахов при сохранении прежнего уровня Ме.
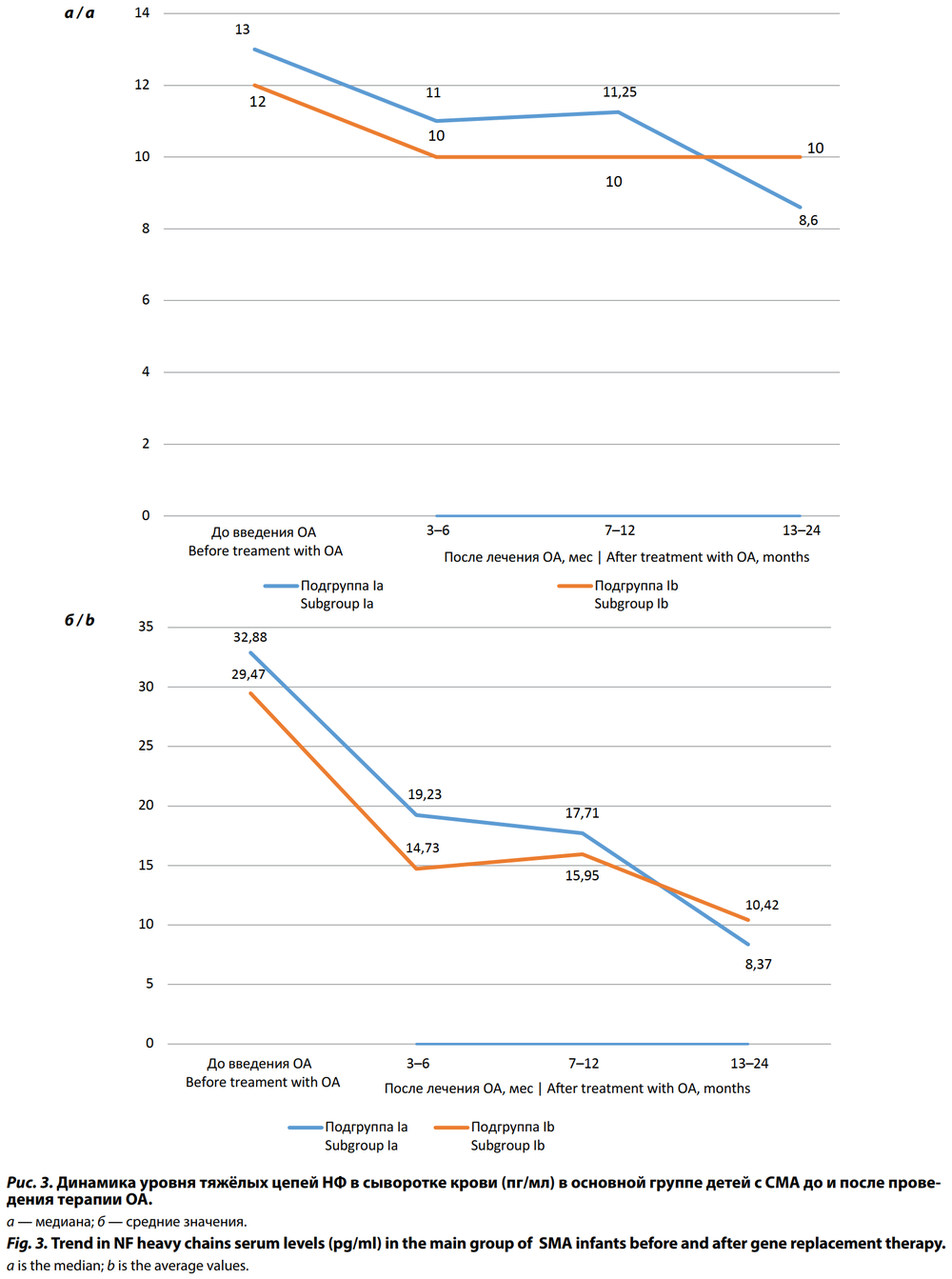
Анализ динамики уровней тяжёлых цепей НФ в сыворотке крови после проведения генной терапии ОА как в подгруппе Ia, так и в подгруппе Ib выявил те же закономерности, что и анализ динамики лёгких цепей НФ: достоверное снижение уровня тяжёлых цепей НФ через 3–6 мес после введения ОА (рис. 3) и в дальнейшем, через 7–12 и 13–24 мес, плавное снижение Ме при уменьшении интерквартильных размахов.
Достоверные статистические различия отмечены только между уровнями лёгких цепей НФ в сыворотке крови у детей группы контроля и подгруппы Ia через 3–6 мес после терапии ОА (р = 0,01); через 7–12 и 13–24 мес показатели уже не имели статистических различий. Уровни тяжёлых цепей НФ в сыворотке крови у детей группы контроля и подгруппы Ia через 3–6, 7–12 и 13–24 мес после терапии ОА значимо не различались. Достоверных различий в показателях как лёгких, так и тяжёлых цепей НФ в сыворотке крови между группой контроля и подгруппой Ib через 3–6, 7–12 и 13–24 мес после терапии ОА не выявлено.
Заключение
На основании проведённого исследования уровней лёгких и тяжёлых цепей НФ в сыворотке крови у детей без неврологической патологии и с СМА были установлены следующие закономерности.
У детей без неврологической патологии в возрасте 0–24 мес уровни лёгких и тяжёлых цепей НФ в сыворотке крови характеризуются широким разбросом показателей, не подчиняются нормальному распределению и не имеют корреляционной связи с возрастом, что согласуется с данными о вариативности уровней НФ, полученных методами ИФА [2, 5].
У пациентов на пресимптоматической стадии СМА статистические различия уровней лёгких и тяжёлых цепей НФ в сыворотке крови в сравнении с группой контроля отсутствуют. При этом у детей с инфантильным дебютом СМА имеют место достоверно более высокие показатели НФ по сравнению как с детьми с СМА без клинических симптомов заболевания, так и с группой контроля, что указывает на развёрнутые процессы нейродегенерации при наличии клинической картины болезни.
Применение генной терапии у пациентов с СМА замедляет дегенерацию α-мотонейронов передних рогов спинного мозга, что проявляется значимым снижением уровней лёгких и тяжёлых цепей НФ в сыворотке крови при оценке данных показателей в динамике. Максимальное снижение показателей НФ отмечается через 3–6 мес после лечения ОА.
Таким образом, определение уровней лёгких и тяжёлых цепей НФ в сыворотке крови у пациентов с СМА до и после генной терапии может расцениваться как маркер тяжести заболевания и эффективности лечения.
Список литературы
1. Фисенко Д.А., Кузенкова Л.М., Куренков А.Л., Увакина Е.В., Попович С.Г. Нейрофиламенты как биомаркер спинальной мышечной атрофии. Неврологический журнал имени Л.О. Бадаляна. 2023; 4(3): 130–6. https://doi.org/10.46563/2686-8997-2023-4-3-130-136 https://elibrary.ru/epnbqa
2. Владыкина А.В., Назаров В.Д., Краснов В.С., Королева Е.И., Федорова П.А., Мошникова А.Н. и др. Исследование диагностической значимости тяжелых цепей нейрофиламентов в цереброспинальной жидкости при боковом амиотрофическом склерозе. Анналы клинической и экспериментальной неврологии. 2021; 15(1): 43–50. https://doi.org/10.25692/ACEN.2021.1.5 https://elibrary.ru/gemjpp
3. Gafson A.R., Barthélemy N.R., Bomont P., Carare R.O., Durham H.D., Julien J.P., et al. Neurofilaments: neurobiological foundations for biomarker applications. Brain. 2020; 143(7): 1975–98. https://doi.org/10.1093/brain/awaa098
4. Xu Z., Henderson R.D., David M., McCombe P.A. Neurofilaments as biomarkers for amyotrophic lateral sclerosis: a systematic review and meta-analysis. PLoS One. 2016; 11(10): e0164625. https://doi.org/10.1371/journal.pone.0164625
5. Wong Y.Y.M., Bruijstens A.L., Barro C., Michalak Z., Melief M.J., Wierenga A.F., et al. Serum neurofilament light chain in pediatric MS and other acquired demyelinating syndromes. Neurology. 2019; 93(10): e968–74. https://doi.org/10.1212/wnl.0000000000008057
6. Körtvelyessy P., Kuhle J., Düzel E., Vielhaber S., Schmidt C., Heinius A., et al. Ratio and index of Neurofilament light chain indicate its origin in Guillain-Barré syndrome. Ann. Clin. Transl. Neurol. 2020; 7(11): 2213–20. https://doi.org/10.1002/acn3.51207
7. Nitz E., Smitka M., Schallner J., Akgün K., Ziemssen T., von der Hagen M., et al. Serum neurofilament light chain in pediatric spinal muscular atrophy patients and healthy children. Ann. Clin. Transl. Neurol. 2021; 8(10): 2013–24. https://doi.org/10.1002/acn3.51449
8. Wurster C.D., Steinacker P., Günther R., Koch J.C., Lingor P., Uzelac Z., et al. Neurofilament light chain in serum of adolescent and adult SMA patients under treatment with nusinersen. J. Neurol. 2020; 267(1): 36–44. https://doi.org/10.1007/s00415-019-09547-y
9. Khalil M., Teunissen C.E., Otto M., Piehl F., Sormani M.P., Gattringer T., et al. Neurofilaments as biomarkers in neurological disorders. Nat. Rev. Neurol. 2018; 14(10): 577–89. https://doi.org/10.1038/s41582-018-0058-z
10. Gordon B.A. Neurofilaments in disease: what do we know? Curr. Opin. Neurobiol. 2020; 61: 105–15. https://doi.org/10.1016/j.conb.2020.02.001
11. Steinacker P., Feneberg E., Weishaupt J., Brettschneider J., Tumani H., Andersen P.M., et al. Neurofilaments in the diagnosis of motoneuron diseases: a prospective study on 455 patients. J. Neurol. Neurosurg. Psychiatry. 2016; 87(1): 12–20. https://doi.org/10.1136/jnnp-2015-311387
12. Brettschneider J., Petzold A., Süßmuth S.D., Ludolph A.C., Tumani H. Axonal damage markers in cerebrospinal fluid are increased in ALS. Neurology. 2006; 66(6): 852–6. https://doi.org/10.1212/01.wnl.0000203120.85850.54
13. De Schaepdryver M., Goossens J., De Meyer S., Jeromin A., Masrori P., Brix B., et al. Serum neurofilament heavy chains as early marker of motor neuron degeneration. Ann. Clin. Transl. Neurol. 2019; 6(10): 1971–9. https://doi.org/10.1002/acn3.50890
14. Boylan K.B., Glass J.D., Crook J.E., Yang C., Thomas C.S., Desaro P., et al. Phosphorylated neurofilament heavy subunit (pNF-H) in peripheral blood and CSF as a potential prognostic biomarker in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 2013; 84(4): 467–72. https://doi.org/10.1136/jnnp-2012-303768
15. Halbgebauer S., Steinacker P., Verde F., Weishaupt J., Oeckl P., von Arnim C., et al. Comparison of CSF and serum neurofilament light and heavy chain as differential diagnostic biomarkers for ALS. J. Neurol. Neurosurg. Psychiatry. 2022; 93(1): 68–74. https://doi.org/10.1136/jnnp-2021-327129
16. Revendova K.Z., Zeman D., Bunganic R., Karasova K., Volny O., Bar M., et al. Serum neurofilament levels in patients with multiple sclerosis: A comparison of SIMOA and high sensitivity ELISA assays and contributing factors to ELISA levels. Mult. Scler. Relat. Disord. 2022; 67: 104177. https://doi.org/10.1016/j.msard.2022.104177
17. Lin A.V. Direct ELISA. Methods Mol. Biol. 2015; 1318: 61–7. https://doi.org/10.1007/978-1-4939-2742-5_6
18. RayBiotech. ELISA vs. Immuno-PCR vs. SIMOA: Comparison of protein detection tools. Available at: https://raybiotech.com/elisa-immunopcr-simoa
19. Byrne L.M., Schultz J.L., Rodrigues F.B., van der Plas E., Langbehn D., Nopoulos P.C., et al. Neurofilament light protein as a potential blood biomarker for Huntington’s disease in children. Mov. Disord. 2022; 37(7): 1526–31. https://doi.org/10.1002/mds.29027
20. Jacobs Sariyar A., van Pesch V., Nassogne M.C., Moniotte S., Momeni M. Usefulness of serum neurofilament light in the assessment of neurologic outcome in the pediatric population: a systematic literature review. Eur. J. Pediatr. 2023; 182(5): 1941–8. https://doi.org/10.1007/s00431-022-04793-1
21. Reinert M.C., Benkert P., Wuerfel J., Michalak Z., Ruberte E., Barro C., et al. Serum neurofilament light chain is a useful biomarker in pediatric multiple sclerosis. Neurol. Neuroimmunol. Neuroinflamm. 2020; 7(4): e749. https://doi.org/10.1212/nxi.0000000000000749
22. Ferreira-Atuesta C., Reyes S., Giovanonni G., Gnanapavan S. The evolution of Neurofilament light chain in multiple sclerosis. Front. Neurosci. 2021; 15: 642384. https://doi.org/10.3389/fnins.2021.642384
23. Depoorter A., Neumann R.P., Barro C., Fisch U., Weber P., Kuhle J., et al. Neurofilament light chain: blood biomarker of neonatal neuronal injury. Front. Neurol. 2018; 9: 984. https://doi.org/10.3389/fneur.2018.00984
24. Bayoumy S., Verberk I.M.W., Vermunt L., Willemse E., den Dulk B., van der Ploeg A.T., et al. Neurofilament light protein as a biomarker for spinal muscular atrophy: a review and reference ranges. Clin. Chem. Lab. Med. 2024; 62(7): 1252–65. https://doi.org/10.1515/cclm-2023-1311
25. Shahim P., Politis A., van der Merwe A., Moore B., Ekanayake V., Lippa S.M., et al. Time course and diagnostic utility of NfL, tau, GFAP, and UCH-L1 in subacute and chronic TBI. Neurology. 2020; 95(6): e623–36. https://doi.org/10.1212/wnl.0000000000009985
26. Evers K.S., Hügli M., Fouzas S., Kasser S., Pohl C., Stoecklin B., et al. Serum Neurofilament levels in children with febrile seizures and in controls. Front. Neurosci. 2020; 14: 579958. https://doi.org/10.3389/fnins.2020.579958
27. Beerepoot S., Heijst H., Roos B., Wamelink M.M.C., Boelens J.J., Lindemans C.A., et al. Neurofilament light chain and glial fibrillary acidic protein levels in metachromatic leukodystrophy. Brain. 2022; 145(1): 105–18. https://doi.org/10.1093/brain/awab304
28. Toorell H., Zetterberg H., Blennow K., Sävman K., Hagberg H. Increase of neuronal injury markers Tau and neurofilament light proteins in umbilical blood after intrapartum asphyxia. J. Matern. Fetal Neonatal Med. 2018; 31(18): 2468–72. https://doi.org/10.1080/14767058.2017.1344964
29. Breville G., Sukockiene E., Vargas M.I., Lascano A.M. Emerging biomarkers to predict clinical outcomes in Guillain-Barré syndrome. Expert Rev. Neurother. 2023; 23(12): 1201–15. https://doi.org/10.1080/14737175.2023.2273386
30. Khalil M., Teunissen C.E., Lehmann S., Otto M., Piehl F., Ziemssen T., et al. Neurofilaments as biomarkers in neurological disorders — towards clinical application. Nat. Rev. Neurol. 2024; 20(5): 269–87. https://doi.org/10.1038/s41582-024-00955-x
31. Jin J., Wei J., Feng Y., Cui Y., Zhou D., Yao M., et al. Plasma neurofilament light chain in Chinese children with later-onset spinal muscular atrophy. Clin. Chem. Lab. Med. 2022; 60(10): e237–9. https://doi.org/10.1515/cclm-2022-0637
32. Gaiani A., Martinelli I., Bello L., Querin G., Puthenparampil M., Ruggero S., et al. Diagnostic and prognostic biomarkers in amyotrophic lateral sclerosis: neurofilament light chain levels in definite subtypes of disease. JAMA Neurol. 2017; 74(5): 525–32. https://doi.org/10.1001/jamaneurol.2016.5398
33. Poesen K., Van Damme P. Diagnostic and prognostic performance of Neurofilaments in ALS. Front. Neurol. 2019; 9: 1167. https://doi.org/10.3389/fneur.2018.01167
34. Witzel S., Huss A., Nagel G., Rosenbohm A., Rothenbacher D., Peter R.S., et al. Population-based evidence for the use of serum Neurofilaments as individual diagnostic and prognostic biomarkers in amyotrophic lateral sclerosis. Ann. Neurol. 2024; 96(6): 1040–57. https://doi.org/10.1002/ana.27054
35. Dalla Costa G., Martinelli V., Sangalli F., Moiola L., Colombo B., Radaelli M., et al. Prognostic value of serum neurofilaments in patients with clinically isolated syndromes. Neurology. 2019; 92(7): e733–41. https://doi.org/10.1212/wnl.0000000000006902
36. Matsushige T., Inoue H., Fukunaga S., Hasegawa S., Okuda M., Ichiyama T. Serum neurofilament concentrations in children with prolonged febrile seizures. J. Neurol. Sci. 2012; 321(1-2): 39–42. https://doi.org/10.1016/j.jns.2012.07.043
37. Douglas-Escobar M., Yang C., Bennett J., Shuster J., Theriaque D., Leibovici A., et al. A pilot study of novel biomarkers in neonates with hypoxic-ischemic encephalopathy. Pediatr. Res. 2010; 68(6): 531–6. https://doi.org/10.1203/pdr.0b013e3181f85a03
38. Sandelius Å., Zetterberg H., Blennow K., Adiutori R., Malaspina A., Laura M., et al. Plasma neurofilament light chain concentration in the inherited peripheral neuropathies. Neurology. 2018; 90(6): e518–24. https://doi.org/10.1212/wnl.0000000000004932
39. Darras B.T., Crawford T.O., Finkel R.S., Mercuri E., De Vivo D.C., Oskoui M., et al. Neurofilament as a potential biomarker for spinal muscular atrophy. Ann. Clin. Transl. Neurol. 2019; 6(5): 932–44. https://doi.org/10.1002/acn3.779
40. Alves C.R.R., Petrillo M., Spellman R., Garner R., Zhang R., Kiefer M., et al. Implications of circulating neurofilaments for spinal muscular atrophy treatment early in life: A case series. Mol. Ther. Methods Clin. Dev. 2021; 23: 524–38. https://doi.org/10.1016/j.omtm.2021.10.011
41. Flotats-Bastardas M., Bitzan L., Grell C., Martakis K., Winter B., Zemlin M., et al. Paradoxical increase of neurofilaments in SMA patients treated with onasemnogene abeparvovec-xioi. Front. Neurol. 2023; 14: 1269406. https://doi.org/10.3389/fneur.2023.1269406
Об авторах
Дарья Андреевна ФисенкоРоссия
Аспирант, врач-невролог, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия 119991, Москва
e-mail: fisenko.daria@mail.ru
Людмила Михайловна Кузенкова
Россия
Доктор мед. наук, профессор, начальник центра детской психоневрологии, зав. отделением психоневрологии и нейрореабилитации, врач-невролог, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия; Клинический институт детского здоровья имени Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ имени И.М. Сеченова» Минздрава России (Сеченовский Университет), 119435, Москва, Россия
Алексей Львович Куренков
Россия
Доктор мед. наук, зав. лаб. нервных болезней, врач-невролог, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Елена Леонидовна Семикина
Россия
Доктор мед. наук, зав. лабораторным отделом, гл. науч. сотр., врач лабораторной диагностики, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Евгения Владимировна Увакина
Россия
Канд. мед. наук, врач-невролог, ст. науч. сотр. лаб. нервных болезней, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Владислав Владимирович Черников
Россия
Канд. мед. наук, зав. отделением диагностики и восстановительного лечения, начальник методического аккредитационно-симуляционного центра, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Ольга Владимировна Курбатова
Россия
Канд. мед. наук, ст. науч. сотр., врач клинической лабораторной диагностики, и.о. зав. лаб. экспериментальной иммунологии и вирусологии, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Татьяна Михайловна Комягина
Россия
Мл. науч. сотр. лаб. экспериментальной иммунологии и вирусологии, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Матвей Валерьевич Коняшин
Россия
Врач клинической лабораторной диагностики лаб. экспериментальной иммунологии и вирусологии, ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
София Георгиевна Попович
Россия
Врач-невролог, мл. науч. сотр. ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
Рецензия
Для цитирования:
Фисенко Д.А., Кузенкова Л.М., Куренков А.Л., Семикина Е.Л., Увакина Е.В., Черников В.В., Курбатова О.В., Комягина Т.М., Коняшин М.В., Попович С.Г. Динамика уровней лёгких и тяжёлых цепей нейрофиламентов в сыворотке крови детей со спинальной мышечной атрофией на фоне применения генной терапии. Неврологический журнал имени Л.О. Бадаляна. 2025;6(1):26-36. https://doi.org/10.46563/2686-8997-2025-6-1-26-36. EDN: usswzn
For citation:
Fisenko D.A., Kuzenkova L.M., Kurenkov A.L., Semikina E.L., Uvakina E.V., Chernikov V.V., Kurbatova O.V., Komyagina T.M., Konyashin M.V., Popovich S.G. Trend in blood serum levels of light and heavy chains of neurofilaments in infants with spinal muscular atrophy against background of the use of gene therapy. L.O. Badalyan Neurological Journal. 2025;6(1):26-36. (In Russ.) https://doi.org/10.46563/2686-8997-2025-6-1-26-36. EDN: usswzn




























