Перейти к:
Уровень циркулирующих нейрофиламентов как биомаркёр спинальной мышечной атрофии при генотерапии препаратом онасемноген абепарвовек
https://doi.org/10.46563/2686-8997-2025-6-3-153-159
EDN: mlkcsw
Аннотация
Цель статьи — анализ современных данных о роли уровня циркулирующих нейрофиламентов как биомаркёра спинальной мышечной атрофии (СМА) при генотерапии препаратом онасемноген абепарвовек. СМА — это орфанное наследственное аутосомно-рецессивное заболевание, обусловленное дефектами гена SMN1, кодирующего белок SMN. При СМА происходит гибель α-мотонейронов спинного мозга, приводящая к прогрессирующей мышечной слабости. Онасемноген абепарвовек — генозаместительная терапия, направленная на восстановление экспрессии белка SMN при СМА. В обзоре подчёркивается необходимость формирования панели биомаркёров для оценки тяжести СМА и эффективности терапии, поскольку клинические методы часто недостаточно чувствительны для мониторинга ответа на лечение. Нейрофиламенты — структурные белки аксонов, высвобождающиеся при повреждении нейронов, рассматриваются как перспективные биомаркеры, которые отражают степень нейродегенерации и динамику заболевания. На сегодняшний день количество исследований, посвящённых использованию циркулирующих нейрофиламентов при СМА при терапии препаратом онасемноген абепарвовек, невелико, что требует дальнейших клинических и лабораторных исследований для подтверждения их значимости. Обзор систематизирует данные о молекулярно-генетических основах патогенеза СМА, существующей на данный момент терапии и потенциале нейрофиламентов как биомаркёров при генотерапии препаратом онасемноген абепарвовек. Сделан вывод о необходимости дальнейших исследований в этой области для оптимизации персонализированного подхода к лечению пациентов со СМА.
Участие авторов:
Чудакова Д.А. — концепция, сбор материала и обработка данных, обзор публикаций по теме, написание текста, редактирование статьи;
Увакина Е.И. — концепция и дизайн статьи, обзор публикаций по теме, написание текста, редактирование.
Все соавторы — утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи.
Финансирование. Работа выполнена в рамках реализации государственного задания и проведения научно-исследовательской работы «Изучение этиологических особенностей редких болезней, имеющих патогенетическую терапию» № 1220032300501-0.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Поступила 02.09.2025
Принята к печати 16.09.2025
Опубликована 31.10.2025
Для цитирования:
Чудакова Д.А., Увакина Е.В. Уровень циркулирующих нейрофиламентов как биомаркёр спинальной мышечной атрофии при генотерапии препаратом онасемноген абепарвовек. Неврологический журнал имени Л.О. Бадаляна. 2025;6(3):153-159. https://doi.org/10.46563/2686-8997-2025-6-3-153-159. EDN: mlkcsw
For citation:
Chudakova D.A., Uvakina E.V. Level of circulating neurofilaments as a biomarker of spinal muscular atrophy during gene therapy with onasemnogene abeparvovec. L.O. Badalyan Neurological Journal. 2025;6(3):153-159. (In Russ.) https://doi.org/10.46563/2686-8997-2025-6-3-153-159. EDN: mlkcsw
Введение
Спинальная мышечная атрофия (СМА) — это орфанное наследственное аутосомно-рецессивное нервно-мышечное заболевание вследствие дегенерации α-мотонейронов передних рогов спинного мозга, характеризующееся прогрессирующими симптомами вялого паралича и мышечной атрофии. Хотя при данном заболевании наиболее сильно выражено именно поражение мотонейронов, в какой-то мере его можно считать системным, т. к. при тяжёлых формах СМА также наблюдаются патологии сердечно-сосудистой системы, поджелудочной железы, печени, головного мозга, скелетной мускулатуры, иммунной системы и др. [1, 2].
Большинство пациентов со СМА — это дети и подростки. СМА — второе по частоте наследственное аутосомно-рецессивное заболевание, его частота составляет 1 на 6000–10 000 новорождённых, а частота гетерозиготного носительства патогенных аллелей, вызывающих СМА, находится в диапазоне 1 : 40–1 : 50 [3]. При отсутствии необходимой терапии СМА остаётся основной причиной детской смертности от наследственных заболеваний. Существует несколько основных видов терапии СМА, в том числе генотерапия, что делает необходимой разработку подходов к оценке её эффективности у конкретного пациента.
Молекулярно-генетические основы патогенеза СМА
Относительно хорошо изучены молекулярно-генетические основы патогенеза СМА. В подавляющем большинстве случаев СМА вызвана дефектами гена SMN1, приводящими к дефициту кодируемого этим геном полноразмерного белка SMN-FL (SMN full length). Данный белок участвует во множестве ключевых клеточных процессов, однако особенно важен при нейрогенезе и осуществлении нейромышечной синаптической передачи [4–6]. В геноме человека у гена SMN1 существует практически идентичный ему паралог — ген SMN2, отличающийся от SMN1 только несколькими нуклеотидами. Из этих отличий особенно функционально значима замена нуклеотида С на Т в сайте сплайсинга в экзоне 7 (c.840C>T). Данная замена приводит к тому, что экзон 7, как правило, вырезается при сплайсинге мРНК, а в белке SMNΔ7, который транслируется с этой мРНК, оказывается экспонирована сигнальная последовательность, направляющая его на деградацию (т. е. этот белок нестабилен). В результате только с ~10% мРНК гена SMN2 осуществляется трансляция SMN-FL. В геноме может быть разное количество копий гена SMN2 (от 0 до 5 и более), и существует обратная корреляция между числом копий данного гена и тяжестью заболевания. Принято выделять 5 типов СМА, где: 0 — наиболее тяжёлая форма, при которой смерть наступает в период внутриутробного развития или вскоре после рождения, IV — самая лёгкая форма, при которой продолжительность жизни может не отличаться от таковой у здорового человека. Однако тяжесть СМА лишь отчасти определяется количеством копий гена SMN2, т. к. заболевание может протекать по-разному у пациентов с одинаковым числом копий этого гена, и существуют дополнительные генетические и/или эпигенетические факторы, определяющие особенности патогенеза [7, 8].
Терапия СМА
Существует несколько основных видов терапии СМА. В первую очередь, это генотерапия препаратом онасемноген абепарвовек (ОА; коммерческое название Золгенсма), при которой в клетки доставляется ген SMN1 в составе эписомальной ДНК аденоассоциированного вектора серотипа 9 (AAV9). Также применяется терапия, влияющая на сплайсинг мРНК, транскрибируемой с гена SMN2. Существуют два таких лекарственных препарата (ЛП), прошедших клинические испытания, — препараты на основе антисмыслового олигонуклеотида (нусинерсен, коммерческие названия Спинраза и Лантесенс) или малой молекулы (рисдиплам, коммерческое название Эврисди). Терапия этими ЛП приводит к тому, что во всех клетках, в которые они поступили, увеличивается уровень зрелой полноразмерной мРНК, экспрессирующейся c гена SMN2 с экзоном 7, что приводит к повышению уровня SMN-FL. Совместное применение этих двух видов терапии не исключено. Ведётся поиск дополнительных препаратов, которые можно применять в сочетании с вышеупомянутыми видами терапии [9].
Поскольку тяжёлые формы СМА ведут к инвалидизации и смерти пациента, а вовремя начатое лечение данными ЛП приводит к значительной компенсации патологии, особенно важно своевременно выявить пациентов, нуждающихся в немедленном начале терапии. При этом для ряда пациентов терапия может оказаться недостаточно эффективной, и в таких группах пациентов необходимо выявление мишеней для вспомогательной терапии и определение молекулярных механизмов, приводящих к такой недостаточной восприимчивости к проводимому лечению. Это позволит достигнуть максимальной эффективности проводимого лечения. Очевидно, что для этого необходимо использовать множественные биомаркёры патологических процессов и влияния на них терапии.
Цель работы — оценить клиническую значимость широкого спектра потенциальных биомаркёров именно в контексте одномоментной терапии генотерапевтическим препаратом ОА. Это может позволить выявить наиболее перспективные из них для дальнейшего применения в клинике или, напротив, исключить целесообразность применения некоторых из протестированных биомаркёров для решения данной задачи.
Биомаркеры для оценки эффективности терапии СМА
ОА начал применяться относительно недавно (с 2019 г. в США и с 2020 г. в России), и до настоящего времени отсутствовали масштабные лонгитюдные исследования, оценивающие особенности клеточного ответа на данную терапию, в том числе направленные на выявление клинически значимых биомаркёров.
В то же время есть множество работ, в которых такие биомаркёры использовали для оценки эффективности терапии СМА при лечении значительного числа пациентов другими ЛП. Эти работы обобщены в ряде зарубежных и отечественных обзоров [10–12]. Согласно этим работам наиболее часто в качестве биомаркёров при СМА и терапии ЛП, влияющими на сплайсинг мРНК гена SMN2, используют уровень (в плазме или сыворотке крови, или в спинномозговой жидкости) нейрофиламентов (НФ) — лёгкой цепи НФ (NfL) и фосфорилированной тяжёлой цепи НФ (pNfH). Эти белки есть только в нейронах, в большом количестве находятся в аксонах, и возрастание их уровня в крови или спинномозговой жидкости — это признак массовой гибели нейронов. В ряде работ показано, что уровень NfL и pNfH снижается при эффективной патогенетической терапии СМА, а их базальный уровень может коррелировать с тяжестью СМА и числом копий гена SMN2. При этом необходимо учитывать, что в норме уровень циркулирующих в крови НФ относительно высок в первые месяцы после рождения и снижается по мере взросления. Поэтому важно параллельно с оценкой их уровня в когорте пациентов проводить мониторинг этих маркёров в группе здоровых доноров того же возраста или среди пациентов с заболеваниями, не приводящими к нейромышечной дегенерации, или опираться на опубликованные данные и математические модели, предсказывающие уровень циркулирующих НФ [13].
Циркулирующие нейрофиламенты как биомаркеры при терапии препаратом онасемноген абепарвовек
Ранее в мировой медицинской литературе существовали только две работы по оценке использования уровня циркулирующих НФ как биомаркёров при терапии ОА, обе с неожиданными, неоднозначными результатами.
В исследовании, опубликованном в декабре 2023 г. и оценивающем изменения уровня циркулирующих НФ при терапии ОА, в том числе среди пациентов, получавших до этого нусинерсен и рисдиплам, выявлено парадоксальное резкое увеличение уровня NfL после начала терапии [14] (рис. 1).
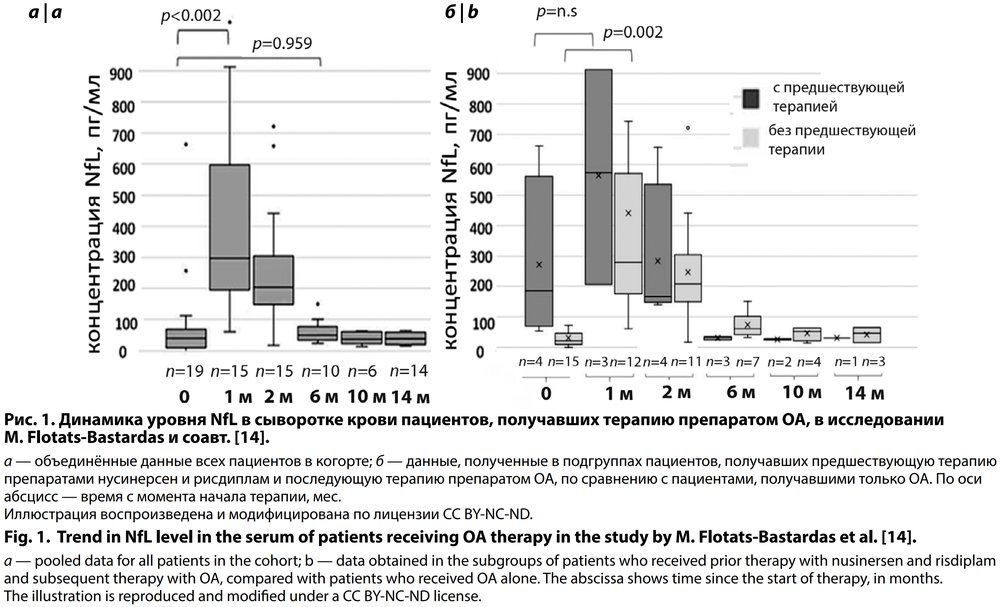
Это, возможно, является следствием ответа нейронов на вектор AAV9, в котором ген SMN1 доставляется в нейроны в составе препарата. В самом деле, такой же эффект (увеличение уровня НФ в плазме и сыворотке крови, а также в спинномозговой жидкости после внутривенного или интратекального введения AAV9 векторов) наблюдали у макак (Cynomolgus macaques); снижение уровня циркулирующих НФ до изначального происходило примерно на 75-й день после инфузии [15]. В исследовании на самцах крыс при введении разных доз вектора AAV9 с геном SMN1, в том числе превышающих безопасную концентрацию и приводящих к частичной нейродегенерации, также наблюдалось дозозависимое повышение уровня НФ в ответ на введение вектора AAV9, соответствующее степени его нейротоксичности, оценённой гистологически [16].
В случае пациентов в вышеупомянутой статье M. Flotats-Bastardas и соавт. измерения проводили в сыворотке крови через 1, 2, 6, 10 и 14 мес после начала терапии. Уровень NfL возрастал уже к первому измерению и держался на высоком уровне как минимум до 60-го дня. На 6-й месяц он снижался к уровню, который был на начало терапии (рис. 1). При этом у большинства пациентов наблюдалось значимое улучшение показателей, на которые направлена терапия СМА (моторных функций).
Схожий эффект наблюдали в другом исследовании с похожим дизайном, где уровень NfL и pNfH в сыворотке крови возрастал — хотя и не у всех, а у многих пациентов — при терапии внутривенным введением ОА, при этом измерения проводились примерно каждые 3 мес после его введения [17] (рис. 2).

Примечательно, что предшествующая терапия препаратом нусинерсен или рисдиплам в ряде случаев «сглаживала» пик уровня циркулирующих НФ после начала терапии препаратом ОА в обоих исследованиях (рис. 1, 3).

Число пациентов в обеих работах было невелико, т. е. эти исследования можно считать «пилотными». Так, в исследовании C.R. Alves и соавт. участвовали только 9 пациентов со СМА, получавших терапию нусинерсеном, 7 пациентов, проходивших лечение препаратом ОА, и 6 пациентов, получавших оба вида терапии. В работе M. Flotats-Bastardas и соавт. наивных пациентов было 19, на 1-м и 2-м измерении (1 и 2 мес после начала терапии) — 15, на 3-м (6-й месяц после начала терапии) — 10, на 4-м (10-й месяц после начала терапии) — 6, по завершении исследования на 14-й месяц после начала терапии — 4. Когорта также была довольно неоднородна по возрасту (от 2 до 46 мес), а измерение уровня НФ для некоторых пациентов проводили в другой лаборатории и другим методом (отметим, что принято считать, что эти методы дают сходные результаты [18]. Несмотря на и так небольшое количество пациентов, когорта была неоднородна и в плане наличия или отсутствия предшествующей терапии другими препаратами. Всё это отмечают и сами авторы. Поэтому возникла необходимость дальнейших более масштабных исследований, отвечающих на вопрос, можно ли использовать уровень НФ как биомаркёр при терапии ОА.
В апреле 2025 г. в «Неврологическом журнале имени Л.О. Бадаляна» опубликованы результаты отечественной работы, проведённой на большой когорте пациентов со СМА (79 пациентов), а также в контрольной группе неврологически здоровых детей [19]. Установлено значимое снижение уровня NfL в сыворотке крови пациентов со СМА через 3–6 мес после начала терапии. При этом «парадоксальный пик» увеличения уровня циркулирующих НФ у некоторых пациентов в зарубежных работах наблюдали в основном до 3–6 мес после начала терапии, и начиная с 1-го месяца начинался спад этого «пика» (рис. 1). Крайне небольшое количество пациентов на более поздних сроках после начала терапии в опубликованных зарубежных работах (например, 7 пациентов на 6-й месяц, 4 на 10-й и 3 на 14-й в исследовании M. Flotats-Bastardas и соавт. [14] не позволяет провести сравнение этих данных с отечественными.
Заключение
Собранные на настоящий момент данные свидетельствуют о том, что уровень циркулирующих НФ, определяемый в сыворотке крови, можно использовать как биомаркёр гибели нейронов, отражающий тяжесть заболевания (или клеточный ответ на вектор AAV9), а также для оценки эффективности терапии препаратом ОА через 3–6 мес после начала терапии. Необходимы дальнейшие исследования в этой области для разработки и оптимизации персонализированной терапии пациентов со СМА.
Список литературы
1. Yeo C.J.J., Darras B.T. Overturning the paradigm of spinal muscular atrophy as just a motor neuron disease. Pediatr. Neurol. 2020; 109: 12–9. https://doi.org/10.1016/j.pediatrneurol.2020.01.003
2. Deguise M.O., Kothary R. New insights into SMA pathogenesis: immune dysfunction and neuroinflammation. Ann. Clin. Transl. Neurol. 2017; 4(7): 522–30. https://doi.org/10.1002/acn3.423
3. Wirth B., Karakaya M., Kye M.J., Mendoza-Ferreira N. Twenty-five years of spinal muscular atrophy research: from phenotype to genotype to therapy, and what comes next. Annu. Rev. Genomics Hum. Genet. 2020; 21: 231–61. https://doi.org/10.1146/annurev-genom-102319-103602
4. Singh R.N., Howell M.D., Ottesen E.W., Singh N.N. Diverse role of survival motor neuron protein. Biochim. Biophys. Acta Gene Regul. Mech. 2017; 1860(3): 299–315. https://doi.org/10.1016/j.bbagrm.2016.12.008
5. Boda B., Mas C., Giudicelli C., Nepote V., Guimiot F., Levacher B., et al. Survival motor neuron SMN1 and SMN2 gene promoters: identical sequences and differential expression in neurons and non-neuronal cells. Eur. J. Hum. Genet. 2004; 12(9): 729–37. https://doi.org/10.1038/sj.ejhg.5201217
6. Kim J.K., Jha N.N., Awano T., Caine C., Gollapalli K., Welby E., et al. A spinal muscular atrophy modifier implicates the SMN protein in SNARE complex assembly at neuromuscular synapses. Neuron. 2023; 111(9): 1423–39. https://doi.org/10.1016/j.neuron.2023.02.004
7. Maretina M.A., Zheleznyakova G.Y., Lanko K.M., Egorova A.A., Baranov V.S., Kiselev A.V. Molecular factors involved in spinal muscular atrophy pathways as possible disease-modifying candidates. Curr. Genomics. 2018; 19(5): 339–55. https://doi.org/10.2174/1389202919666180101154916
8. Chudakova D., Kuzenkova L., Fisenko A., Savostyanov K. In search of spinal muscular atrophy disease modifiers. Int. J. Mol. Sci. 2024; 25(20): 11210. https://doi.org/10.3390/ijms252011210
9. Crisafulli S., Boccanegra B., Vitturi G., Trifirò G., De Luca A. Pharmacological therapies of spinal muscular atrophy: a narrative review of preclinical, clinical-experimental, and real-world evidence. Brain Sci. 2023; 13(10): 1446. https://doi.org/10.3390/brainsci13101446
10. Попов К.Д., Алексеева Т.М., Назаров В.Д., Власенко А.И., Малышев С.М. Молекулярные маркеры тяжести заболевания и ответа на терапию нусинерсеном при спинальной мышечной атрофии 5q (обзор литературы). Нервно-мышечные болезни. 2023; 13(3): 33–9. https://doi.org/10.17650/2222-8721-2023-13-3-33-39 https://elibrary.ru/irywnu
11. Lapp H.S., Freigang M., Hagenacker T., Weiler M., Wurster C.D., Günther R. Biomarkers in 5q-associated spinal muscular atrophy – a narrative review. J. Neurol. 2023; 270(9): 4157–78. https://doi.org/10.1007/s00415-023-11787-y
12. Фисенко Д.А., Кузенкова Л.М., Куренков А.Л., Увакина Е.В., Попович С.Г. Нейрофиламенты как биомаркер спинальной мышечной атрофии. Неврологический журнал имени Л.О. Бадаляна. 2023; 4(3): 130–6. https://doi.org/10.46563/2686-8997-2023-4-3-130-136 https://elibrary.ru/epnbqa
13. Paris A., Bora P., Parolo S., MacCannell D., Monine M., van der Munnik N., et al. A pediatric quantitative systems pharmacology model of neurofilament trafficking in spinal muscular atrophy treated with the antisense oligonucleotide nusinersen. CPT Pharmacometrics Syst. Pharmacol. 2023; 12(2): 196–206. https://doi.org/10.1002/psp4.12890
14. Flotats-Bastardas M., Bitzan L., Grell C., Martakis K., Winter B., Zemlin M., et al. Paradoxical increase of neurofilaments in SMA patients treated with onasemnogene abeparvovec-xioi. Front. Neurol. 2023; 14: 1269406. https://doi.org/10.3389/fneur.2023.1269406
15. Johnson E.W., Sutherland J.J., Meseck E., McElroy C., Chand D.H., Tukov F.F., et al. Neurofilament light chain and dorsal root ganglia injury after adeno-associated virus 9 gene therapy in nonhuman primates. Mol. Ther. Methods Clin. Dev. 2023; 28: 208–19. https://doi.org/10.1016/j.omtm.2022.12.012
16. Fader K.A., Pardo I.D., Kovi R.C., Somps C.J., Wang H.H., Vaidya V.S., et al. Circulating neurofilament light chain as a promising biomarker of AAV-induced dorsal root ganglia toxicity in nonclinical toxicology species. Mol. Ther. Methods Clin. Dev. 2022; 25: 264–77. https://doi.org/10.1016/j.omtm.2022.03.017
17. Alves C.R., Petrillo M., Spellman R., Garner R., Zhang R., Kiefer M., et al. Implications of circulating neurofilaments for spinal muscular atrophy treatment early in life: a case series. Mol. Ther. Methods Clin. Dev. 2021; 23: 524–38. https://doi.org/10.1016/j.omtm.2021.10.011
18. Gauthier A., Viel S., Perret M., Brocard G., Casey R.., Lombard C. A comparison of Simoa(TM) and Ella(TM) to assess serum neurofilament-light chain in multiple sclerosis. Ann. Clin. Transl. Neurol. 2021; 8(5): 1141–50. https://doi.org/10.1002/acn3.51355
19. Фисенко Д.А., Кузенкова Л.М., Куренков А.Л., Семикина Е.Л., Увакина Е.В., Черников В.В. и др. Динамика уровней лёгких и тяжёлых цепей нейрофиламентов в сыворотке крови детей со спинальной мышечной атрофией на фоне применения генной терапии. Неврологический журнал имени Л.О. Бадаляна. 2025; 6(1): 26–36. https://doi.org/10.46563/2686-8997-2025-6-1-26-36 https://elibrary.ru/usswzn
Об авторах
Дарья Александровна ЧудаковаРоссия
Канд. биол. наук, ст. науч. сотр. лаб. медицинской геномики ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
e-mail: daria.chudakova.bio@yandex.ru
Евгения Владимировна Увакина
Россия
Канд. мед. наук, врач-невролог, зав. отд. психоневрологии и нейрореабилитации, зам. директора ФГАУ «НМИЦ здоровья детей» Минздрава России, 119991, Москва, Россия
e-mail: uvakina.ev@nzcd.ru
Рецензия
Для цитирования:
Чудакова Д.А., Увакина Е.В. Уровень циркулирующих нейрофиламентов как биомаркёр спинальной мышечной атрофии при генотерапии препаратом онасемноген абепарвовек. Неврологический журнал имени Л.О. Бадаляна. 2025;6(3):153-159. https://doi.org/10.46563/2686-8997-2025-6-3-153-159. EDN: mlkcsw
For citation:
Chudakova D.A., Uvakina E.V. Level of circulating neurofilaments as a biomarker of spinal muscular atrophy during gene therapy with onasemnogene abeparvovec. L.O. Badalyan Neurological Journal. 2025;6(3):153-159. (In Russ.) https://doi.org/10.46563/2686-8997-2025-6-3-153-159. EDN: mlkcsw




























