Перейти к:
Заболевание, обусловленное патогенными вариантами гена филамина А (FLNA): результаты многоцентрового исследования
https://doi.org/10.46563/2686-8997-2025-6-2-72-84
EDN: eacojw
Аннотация
Введение. Патогенные варианты гена FLNA приводят к повреждениям различных органов и систем, формирующимся в эмбриональном периоде. Наиболее часто поражаются головной мозг (эпилепсия), сердечно-сосудистая система (врождённые пороки сердца, лёгочная гипертензия), лёгкие (эмфизема).
Цель исследования — генетическая, клиническая, лабораторно-инструментальная характеристика пациентов с заболеванием, обусловленным патогенными вариантами гена FLNA.
Материалы и методы. Наблюдались 6 девочек с идентифицированными патогенными вариантами гена FLNA. Использованные методы: генеалогический, секвенирование полного экзома, секвенирование по Сэнгеру, электроэнцефалография, магнитно-резонансная томография головного мозга, эхокардиография, катетеризация правых отделов сердца с определением давления и сопротивления в малом круге кровообращения и давления заклинивания лёгочных капилляров, компьютерная томография органов грудной клетки.
Результаты. У всех пациентов диагностирована перивентрикулярная нодулярная гетеротопия и задержка психомоторного развития; у 2 — эпилепсия; у 4 — дисплазия клапанов сердца; у 3 — открытый артериальный проток, у 3 — септальные дефекты, у 2 — двустворчатый аортальный клапан, у 5 — лёгочная гипертензия; у 5 — эмфизема лёгких; у 1 — врождённая диафрагмальная грыжа. За время наблюдения умерли 2 пациента.
Заключение. Постановка диагноза и наблюдение пациентов с патогенными вариантами гена FLNA является вызовом для мультидисциплинарной команды врачей многопрофильного педиатрического стационара. Представленная когорта из 6 пациентов отражает наиболее типичные проявления данной патологии, тяжесть и скорость развития болезни у детей первых лет жизни.
Соблюдение этических стандартов. Исследование проведено в соответствии с Хельсинкской декларацией (2013 г.) с соблюдением федерального закона № 152-ФЗ от 27.07.2006 (ред. от 31.12.2017) «О персональных данных». От законных представителей пациентов было получено добровольное письменное информированное согласие.
Участие авторов:
Мирошниченко В.П. — ведение пациентов, написание текста, сбор материала и обработка данных, обзор публикаций по теме;
Овсянников Д.Ю. — ведение и консультации пациентов, написание текста, сбор материала и обработка данных, концепция, редактирование текста;
Абрамян М.А. — ведение пациентов, концепция, редактирование текста;
Кузенкова Л.М. — редактирование текста, ведение пациента, оценка неврологического статуса пациентов;
Айсина В.А. — анализ и интерпретация данных электроэнцефалографии, сбор материала и обработка данных;
Бойцова Е.В. — обзор публикаций по теме;
Гитинов Ш.А. — ведение пациентов, сбор материала и обработка данных;
Гнеушева О.А. — ведение пациента, сбор материала и обработка данных;
Горбунов А.В. — оценка результатов нейровизуализации, сбор материала и обработка данных;
Горев В.В. — организация медицинской помощи пациентам;
Иванова А.В. — ведение пациента, сбор материала и обработка данных;
Ковалев И.А. — консультация пациента, сбор материала и обработка данных, организация медицинской помощи пациентам;
Кондакова О.Б. — консультация пациентов, сбор материала и обработка данных;
Котлукова Н.П. — консультация пациента, концепция, сбор материала и обработка данных;
Кравченко Н.Е. — обзор публикаций по теме;
Кузнецова А.А. — консультация пациента, сбор материала и обработка данных;
Лялина А.А. — редактирование текста, оценка неврологического статуса и фенотипа пациентов;
Миклашевич И.М. — ведение пациентов, сбор материала и обработка данных;
Петрова С.И. — консультация пациента, сбор материала и обработка данных;
Пушков А.А. — проведение молекулярно-генетической диагностики, анализ и обработка результатов молекулярно-генетической диагностики;
Симонова О.И. — консультация пациента, сбор материала и обработка данных;
Соломатина Н.М. — ведение пациента, сбор материала и обработка данных;
Стрельникова В.А. — сбор материала и обработка данных;
Суетина О.А. — обзор публикаций по теме;
Тележникова Н.Д. — ведение пациента, сбор материала и обработка данных;
Трунина И.И. — консультация пациента, сбор материала и обработка данных.
Савостьянов К.В. — анализ и обработка результатов молекулярно-генетической диагностики, концепция, редактирование текста.
Все соавторы — утверждение окончательного варианта статьи, ответственность за целостность всех частей статьи.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов в связи с публикацией данной статьи.
Поступила 22.04.2025
Принята к печати 28.05.2025
Опубликована 20.08.2025
Ключевые слова
Для цитирования:
Мирошниченко В.П., Овсянников Д.Ю., Абрамян М.А., Кузенкова Л.М., Айсина В.А., Бойцова Е.В., Гитинов Ш.А., Гнеушева О.В., Горбунов А.В., Горев В.В., Иванова А.В., Ковалев И.А., Кондакова О.Б., Котлукова Н.П., Кравченко Н.Е., Кузнецова А.А., Лялина А.А., Миклашевич И.М., Петрова С.И., Пушков А.А., Симонова О.И., Соломатина Н.М., Стрельникова В.А., Суетина О.А., Тележникова Н.Д., Трунина И.И., Савостьянов К.В. Заболевание, обусловленное патогенными вариантами гена филамина А (FLNA): результаты многоцентрового исследования. Неврологический журнал имени Л.О. Бадаляна. 2025;6(2):72-84. https://doi.org/10.46563/2686-8997-2025-6-2-72-84. EDN: eacojw
For citation:
Miroshnichenko V.P., Ovsyannikov D.Yu., Abramyan M.A., Kuzenkova L.M., Aisyna V.A., Boytsova E.V., Gitinov Sh.A., Gneusheva O.V., Gorbunov A.V., Gorev V.V., Ivanova A.V., Kovalev I.A., Kondakova O.B., Kotlukova N.P., Kravchenko N.E., Kuznetsova A.A., Lyalina A.A., Miklashevich I.M., Petrova S.I., Pushkov A.A., Simonova O.I., Solomatina N.M., Strelnikova V.A., Suetina O.A., Telezhnikova N.D., Trunina I.I., Savostyanov K.V. Filamin A (FLNA) gene mutation-associated disease: results of a multicenter study. L.O. Badalyan Neurological Journal. 2025;6(2):72-84. (In Russ.) https://doi.org/10.46563/2686-8997-2025-6-2-72-84. EDN: eacojw
Введение
Мутации в генах, кодирующих структурные белки цитоскелета, оказывают фундаментальное воздействие на организм. Одним из таких белков является филамин А. При повреждении гена FLNA, кодирующего белок филамин А (OMIM #300017), возникают множественные врождённые пороки и аномалии опорно-двигательного аппарата, головного мозга, сердца, лёгких и других органов. До эпохи молекулярно-генетического анализа описываемое заболевание относили к X-сцепленным болезням соединительной ткани с неврологическими, кожными или сосудистыми проявлениями [1]. После внедрения в рутинную практику технологии секвенирования были верифицированы мутации гена, отвечающие за разнообразные структурные нарушения, происходящие в эмбриогенезе. Ген FLNA состоит из 46 кодирующих экзонов. Между 9-м и 10-м экзонами находится специфический терминирующий так называемый «ядовитый экзон», при активации которого в определённых тканях возможно прекращение синтеза белка. Мутации в этой области приводят к тяжёлому фенотипу болезни [2]. В зависимости от типа мутации может возникнуть преждевременная терминация продукции филамина А, в таких случаях развивается перивентрикулярная нодулярная гетеротопия (ПНГ), врождённые пороки сердца (ВПС), дисплазия клапанов сердца [1, 3]. В других случаях мутация приводит к избыточному добавлению 28 аминокислотных остатков на N-конце белка, что при нормальном развитии сердца и мозга вызывает гастроэнтерологические проявления в виде хронического запора, в тяжёлых случаях — мальротации кишечника [4].
Причиной ПНГ является нарушение миграции нейронов в эмбриональном периоде, приводящее к образованию узлов серого вещества перивентрикулярно, что сопровождается эпилепсией и когнитивными нарушениями [5]. Диагноз подтверждается данными магнитно-резонансной томографии (МРТ) головного мозга. Описаны другие аномалии головного мозга: гипоплазия или агенезия мозолистого тела, гипоплазия мозжечка, микроцефалия и др. [6]. Патология сердечно-сосудистой системы, в том числе лёгочного сосудистого русла, разнообразна. Описаны ВПС, такие как открытый артериальный проток, дефекты межпредсердной и межжелудочковой перегородок, патология клапанного аппарата сердца и магистральных сосудов [7]. Лёгочная артериальная гипертензия (ЛАГ) — нередкая патология у пациентов с патогенными вариантами гена FLNA [8]. Симптомы лёгочной патологии могут варьировать от рецидивирующих инфекций нижних дыхательных путей до тяжёлой дыхательной недостаточности (ДН), требующей искусственной вентиляции лёгких (ИВЛ), длительной кислородотерапии, вплоть до потребности в трансплантации лёгких [9, 10]. Хроническая ДН из-за паренхиматозного поражения лёгких приводит к персистирующей гипоксемии, которая, в свою очередь, потенциирует вазоконстрикцию сосудов малого круга кровообращения с последующим ремоделированием артерий и артериол, приводя таким образом к ЛАГ [11]. В наиболее тяжёлых случаях, когда поражён протяжённый участок гена FLNA, манифестация происходит с рождения в виде выраженной ДН, отставания физического и психомоторного развития, а также недостаточности кровообращения на фоне ВПС, ЛАГ. Выполнение инструментальных методов обследования, в том числе МРТ головного мозга, визуализация фенотипа сердца по данным эхокардиографии (ЭхоКГ) позволяют клиницистам заподозрить системный процесс повреждения внутренних органов и головного мозга и отправить ребёнка на генетическое обследование.
Цель исследования — генетическая, клиническая, лабораторно-инструментальная характеристика пациентов с патогенными вариантами гена FLNA.
Материалы и методы
Многоцентровое описательное исследование проводилось на базе нескольких медицинских учреждений, где проходили обследование и лечение 6 детей с выявленными патогенными вариантами гена FLNA. Критериями включения являлись респираторная патология, недостаточность кровообращения на фоне некорригированных ВПС или лёгочной гипертензии (ЛГ), структурная патология головного мозга, подтверждённая данными МРТ у детей с верифицированными патогенными вариантами в гене FLNA. Критериями исключения были отсутствие выполненного молекулярно-генетического исследования или отсутствие патогенного варианта в гене FLNA.
Молекулярно-генетическое исследование проводили методом высокопроизводительного секвенирования с дальнейшей валидацией выявленных генетических вариантов с помощью секвенирования по Сэнгеру. В отдельном случае заподозренная протяжённая делеция экзонов 7–9 гена FLNA была валидирована при помощи ПЦР в режиме реального времени. Ещё в одном клиническом наблюдении потребовался повторный биоинформатический анализ, т. к. результаты предыдущих исследований не укладывались в клиническую картину заболевания ребёнка.
Проводились клинико-генеалогическое, объективное, неврологическое, лабораторное и инструментальное обследования детей, включавшие МРТ головного мозга, электроэнцефалографию (ЭЭГ), в том числе ночной видео-ЭЭГ-мониторинг, ЭхоКГ, электрокардиографию, катетеризацию правых отделов сердца с определением давления и сопротивления в малом круге кровообращения и давления заклинивания лёгочных капилляров; обзорную рентгенографию, компьютерную томографию органов грудной клетки, трахеобронхоскопию. Были проанализированы назначенная терапия и исходы заболевания.
Данные пациентов сравнивали с результатами, полученными при проведении систематического обзора [12]. Статистическую обработку результатов осуществляли при помощи программы «Microsoft Office Excel» («Microsoft»), данные выражали в процентах.
Результаты
Обобщены данные о 6 детях с диагнозом, верифицированным молекулярно-генетическими методами. Результаты и характеристика пациентов представлены в табл. 1. В табл. 2 приведена характеристика пациентов, обследованных нами, в сравнении с данными систематического обзора [12].
Таблица 1. Результаты генетического анализа и характеристика пациентов
Table 1. Results of genetic analysis and patient characteristics
Примечание. ЛГ — лёгочная гипертензия, ЦНС — центральная нервная система, ПНГ — перивентрикулярная узловая гетеротопия, ССЗ — сердечно-сосудистые заболевания, ВПС — врождённый порок сердца, ОАП — открытый артериальный проток, ДМЖП — дефект межжелудочковой перегородки, ДМПП — дефект межпредсердной перегородки, ДАК — двустворчатый аортальный клапан, терапия ЛАГ — терапия лёгочной артериальной гипертензии.
Notes. PH — pulmonary hypertension, CNS — central nervous system, PNH — periventricular nodular heterotopia, CVDs — cardiovascular diseases, CHD — congenital heart defect, PDA — patent ductus arteriosus, VSD — ventricular septal defect, ASD — atrial septal defect, BAV — bicuspid aortic valve, PAH therapy — pulmonary arterial hypertension therapy.
Таблица 2. Характеристики пациентов с патогенными вариантами в гене FLNA в сравнении с данными систематического обзора [12],
число детей (%)
Table 2. Characteristics of patients with pathogenic variants in the FLNA gene compared with data from a systematic review [12], number
of children (%)
Примечание. ЦНС — центральная нервная система, ПНГ — перивентрикулярная узловая гетеротопия, ССЗ — сердечно-сосудистые заболевания, ОАП — открытый артериальный проток, ДМЖП — дефект межжелудочковой перегородки, ДМПП — дефект межпредсердной перегородки, ДАК — двустворчатый аортальный клапан, ЛГ — легочная гипертензия.
Notes. CNS — central nervous system, PNH — periventricular nodular heterotopia, CVDs — cardiovascular diseases, PDA — patent ductus arteriosus, VSD — ventricular septal defect, ASD — atrial septal defect, BAV — bicuspid aortic valve, PH — pulmonary hypertension.
У всех 6 пациентов были выявлены каузальные варианты гена FLNA (табл. 1). Нами выявлены один описанный ранее как патогенный миссенс-вариант и один патогенный вариант, приводящий к нарушению сплайсинга, не описанный ранее. В 2 случаях были установлены небольшие делеции, приводящие к сдвигу рамки считывания, одна из которых не была описана ранее. Еще у 2 пациентов выявлены протяжённые делеции: у пациента № 5 делеция затрагивала экзоны 7–9 гена FLNA и описана ранее в нашем исследовании [13], а у пациента № 2 делеция включала весь ген FLNA и не была описана в базах данных ранее. Семейный сегрегационный анализ позволил установить, что у 4 из 6 пациентов мутации в гене FLNA были выявлены de novo, в остальных случаях обследование родителей не проводилось.
Все пациенты были женского пола; 5 из 6 детей наблюдались в клиниках с рождения из-за ранней манифестации ДН, длительной потребности в респираторной терапии, кислородотерапии. У всех пациентов по данным МРТ головного мозга была выявлена ПНГ. Диагноз эпилепсии был установлен только 2 детям. У всех наблюдавшихся детей была задержка психомоторного развития различной степени. 4 из 6 детей страдали ВПС, у такого же количества по данным ЭхоКГ была установлена дисплазия клапанов сердца, у 5 детей была диагностирована ЛГ, во всех случаях потребовавшая, кроме кислородотерапии, назначения препаратов ЛАГ-специфической терапии. «Золотым» стандартом оценки давления и сопротивления в сосудах малого круга кровообращения, а также посткапиллярной ЛГ является ангиокардиография [15]. В 4 из 6 случаев это исследование было выполнено после назначения ЛАГ-специфической терапии, т. к. в связи с возрастом, массой тела и тяжестью состояния детей не представлялось возможным выполнить её ранее. В 1 случае исследование не было выполнено из-за тяжести состояния ребёнка, в другом оно не было рекомендовано из-за отсутствия ДН, недостаточности кровообращения и изменений при ЭхоКГ. Дилатация восходящей аорты — грозное проявление патологии, ассоциированной с мутацией в гене FLNA, в основном встречающееся после 5 лет жизни и часто связанное с наличием двустворчатого аортального клапана [10]. В нашей серии наблюдений по данным проведённых ЭхоКГ и компьютерной томографии органов грудной клетки только в 1 случае была выявлена дилатация восходящей аорты, которая могла быть усугублена наличием исходно двустворчатого аортального клапана с умеренной степенью стеноза. Также в исследовании представлен пациент с нерестриктивным дефектом межжелудочковой перегородки, что делает невозможным продолжение ЛАГ-терапии (пациент № 6). Данному пациенту было проведено хирургическое закрытие дефекта межжелудочковой перегородки. У 5 детей по данным компьютерной томографии органов грудной клетки были выявлены очаги консолидации лёгочной паренхимы, эмфизематозные изменения, мозаичная пневматизация, линейные фиброзные тяжи (рис. 1). У пациента № 3 сопутствующей патологией явилась диафрагмальная грыжа, потребовавшая проведения оперативного вмешательства в неонатальном периоде. Пациенты с мутациями в гене FLNA часто испытывают трудности при кормлении. У пациента № 6 из-за сочетанной грубой задержки развития, выраженной дыхательной и неврологической патологии были выполнены гастростомия и трахеостомия. В 2 случаях наступил летальный исход: у пациента № 2 — от ДН, кризовой ЛГ на фоне поражения лёгких респираторно-синцитиальной вирусной этиологии (иммунизация паливизумабом не проводилась) в возрасте 1 года; у пациента № 5 — от сердечной недостаточности на фоне кризового течения ЛГ, усугубившегося в связи со стоматологическим оперативным вмешательством в возрасте 2 лет.
В нашем исследовании особого внимания заслуживает больная с эпилепсией, ассоциированной с ПНГ, и отсутствием поражения сердечно-сосудистой и респираторной систем. Приводим соответствующее клиническое наблюдение.
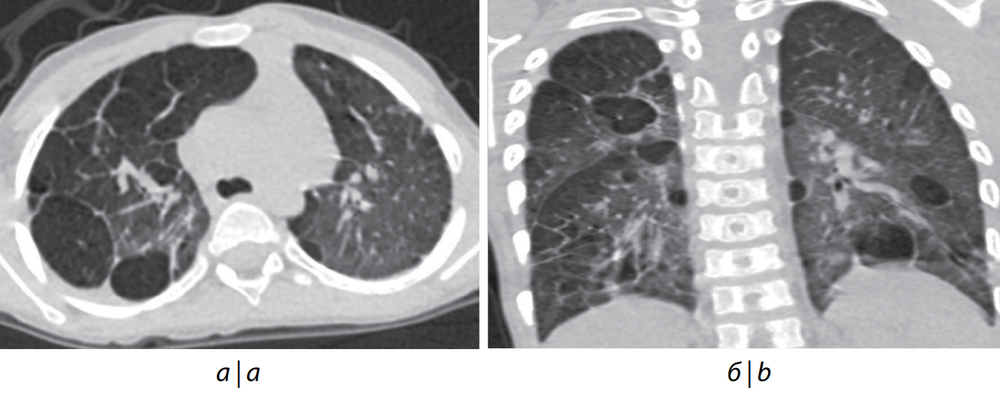
Рис. 1. Компьютерная томография органов грудной клетки пациента № 1 в возрасте 3 лет.
а — аксиальный срез; б — фронтальный срез. Эмфизематозные участки округлой формы с чёткими контурами уплотнения по периферии.
Fig. 1. CT scan of the chest of patient No. 1, 3 years.
а — аxial section; b — frontal section. Emphysematous rounded areas with clear contours of compaction along the periphery.
Клиническое наблюдение
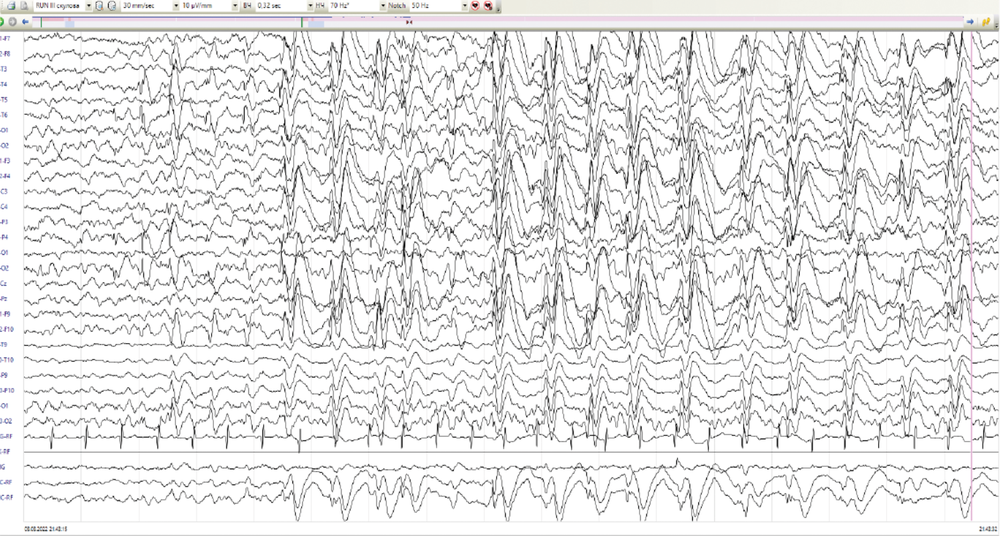
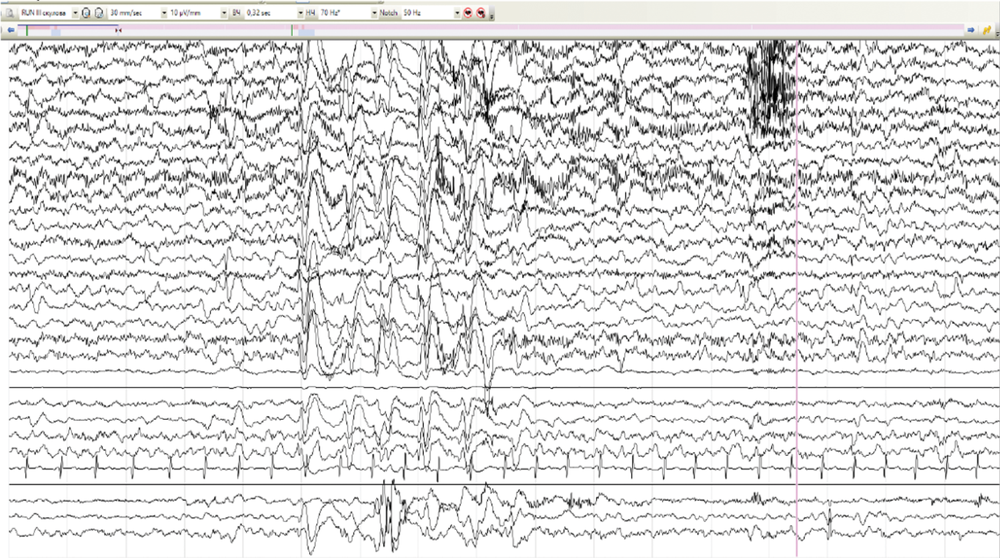
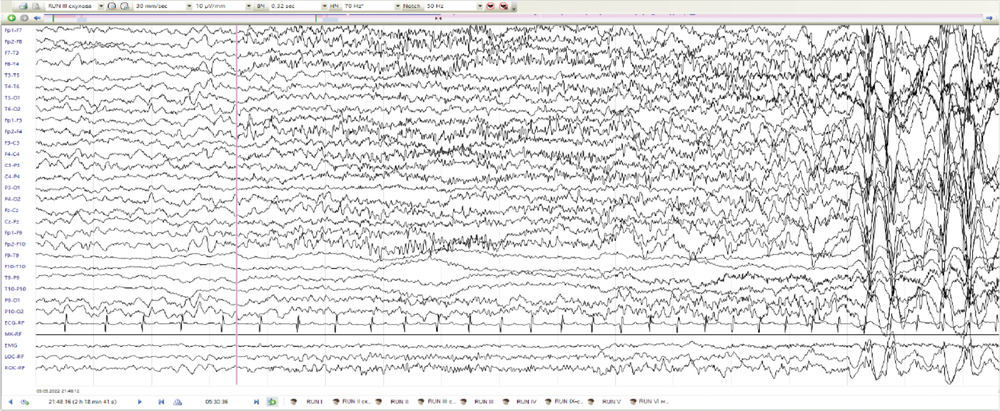
Диагностический поиск у пациента № 4 начался в возрасте 5 лет из-за трудно поддающейся лечению эпилепсии. Пренатальный и неонатальный анамнезы девочки не отягощены. Развитие до 1,5 лет протекало без особенностей. Дебют приступов в возрасте 1 год 6 мес при повышении температуры тела до 40,5оС на фоне острой респираторной вирусной инфекции, со слов мамы, в виде билатерального тонико-клонического судорожного приступа. Состояние расценено в рамках фебрильных судорог. Повторный приступ в возрасте 5 лет на фоне энтеровирусной инфекции, приступ афебрильный, купирован диазепамом. Была назначена противосудорожная терапия вальпроевой кислотой, препарат отменён родителями через неделю, на фоне чего отмечалось появление повторного эпилептического приступа с последующим эпилептическим статусом, купирован в условиях отделения реанимации и интенсивной терапии с формированием пареза Тодда справа. Возобновлена терапия вальпроевой кислотой, на фоне чего спустя 6 мес появились жалобы на эпизоды сна в виде открывания глаз, заведения их вправо, в некоторых случаях с последующими клониями в правой руке продолжительностью менее 1 мин. По месту жительства во время проведения ночного видео-ЭЭГ-мониторинга эпизоды расценены в рамках типичных абсансов. При пересмотре исходных данных зарегистрирована генерализованная эпилептиформная активность, преимущественно в виде «медленных» комплексов острая–медленная волна частотой около 1,5–2,0 Гц (рис. 2, а), а также мультирегиональная эпилептиформная активность, индекс представленности варьировал от низких до средних значений (рис. 2, б). Во сне зарегистрированы фокальные тонические эпилептические приступы с региональным началом иктального паттерна в лобных отделах (рис. 2, в, г). По месту жительства к терапии добавлен ламотриджин с отрицательным эффектом в виде увеличения продолжительности приступов до 10 мин. Ламотриджин заменён на этосуксимид и леветирацетам с положительным эффектом в виде ремиссии в течение 2 лет. По результатам МРТ головного мозга выявлена ПНГ (рис. 3). Секвенирование полного экзома выявило патогенный вариант c.7487_7494del в гене FLNA, приводящий к сдвигу рамки считывания p.Leu2496Hfs*58. Родители девочки здоровы. В связи с отсутствием дыхательной или сердечной недостаточности ребёнок ранее никогда не наблюдался пульмонологом или кардиологом. Неврологическое наблюдение за ребёнком продолжается.
а|a
б|b
в|c
г|d
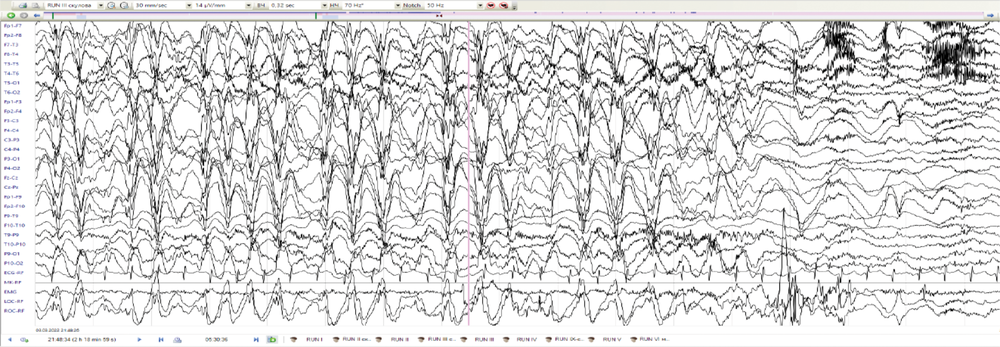
Рис. 2. ЭЭГ пациента № 4.
а — генерализованная эпилептиформная активность комплексов острая–медленная волна частотой 1,5–2,0 Гц; б — генерализованная и мультирегиональная эпилептиформная активность; в — иктальный паттерн фокального тонического приступа с региональным началом в лобных отделах; г — диффузное распространение иктального паттерна.
Fig. 2. EEG of patient No. 4.
a — generalized epileptiform activity of sharp-slow wave complexes with a frequency of 1.5–2.0 Hz; b — generalized and multiregional epileptiform activity; c — ictal pattern of focal tonic seizure, with regional onset in the frontal lobes; d — diffuse spread of ictal pattern.
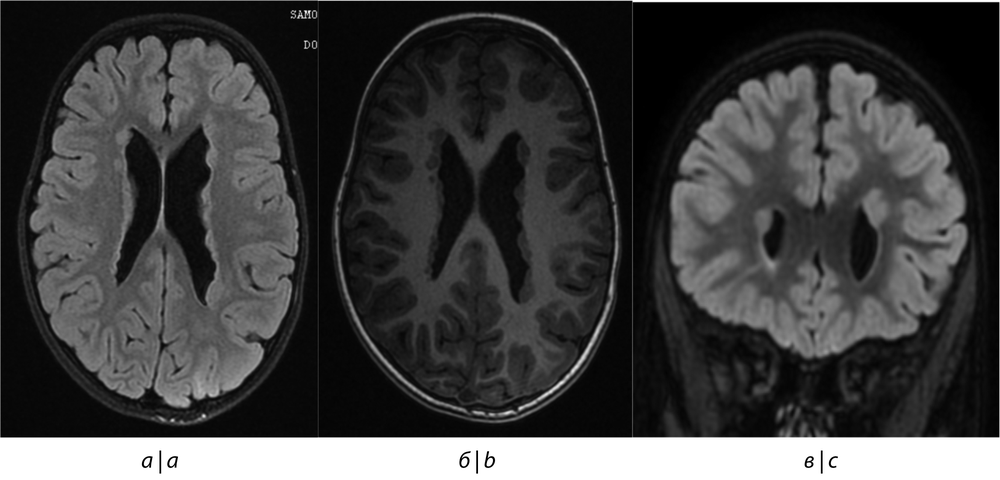
Рис. 3. МРТ головного мозга пациента № 4.
a — в аксиальной проекции в режиме Т2 Flair; б — в аксиальной проекции в режиме FSPGR; в — во фронтальной проекции в режиме Т2 Flair. Наружные стенки боковых желудочков неровные, фестончатые. Субэпендимально в стенках боковых желудочков визуализируются участки, имеющие сигнал, идентичный сигналу от серого вещества мозга, — участки аномально расположенного серого вещества — признаки нодулярной гетеротопии.
Fig. 3. Magnetic resonance images of the brain of patient No. 4.
a — in the axial projection in the T2 Flair mode; b — in the axial projection in the FSPGR mode; c — in the frontal projection in the T2 Flair mode. The outer walls of the lateral ventricles are uneven, scalloped. Subependymally, in the walls of the lateral ventricles, areas are visualized that have a signal identical to the signal from the gray matter of the brain — areas of abnormally located gray matter — signs of nodular heterotopia.
Обсуждение
Исследование ограничено малой выборкой из-за крайне редкой распространённости данного заболевания и впервые в нашей стране включает 6 пациентов. Предыдущая отечественная публикация содержала описания 2 клинических наблюдений [13].
Все дети, включённые в исследование, были женского пола, что связано с Х-сцепленным характером наследования, частой нежизнеспособностью плодов мужского пола с патогенными вариантами гена FLNA. В литературе встречаются описания этой патологии у мальчиков, однако они, как правило, обусловлены миссенс-вариантами гена FLNA [6].
Манифестация заболевания в неонатальном периоде у подавляющего большинства наблюдавшихся нами пациентов обусловлена поражением лёгочного сосудистого русла и потребностью в респираторной поддержке, длительной кислородотерапии. У 1 пациента в неонатальном периоде была диагностирована и оперирована диафрагмальная грыжа, которая могла быть самостоятельным предиктором недоразвития (гипоплазии) лёгочной ткани и ЛГ. В доступной литературе не встретилось наблюдений пациентов с патогенными вариантами гена FLNA и диафрагмальной грыжей.
Пациент № 2 родился недоношенным с малой массой тела при рождении и также имел гипоплазию лёгких. ЛГ у пациентов с патогенными вариантами в гене FLNA в рамках Панамской классификации носит смешанный характер и обусловлена вовлеченностью лёгочной ткани с развитием гипоксемии, ВПС и патологией лёгочного артериального русла [16]. Отставание в физическом и психомоторном развитии у данных пациентов наиболее выражено на 1-м году жизни и в основном приходится на время, когда осуществлялся диагностический поиск. После оптимизации терапии, в том числе терапии ЛГ, начала реабилитационных мероприятий более чем у половины детей отмечалась положительная весовая кривая и успехи в овладении навыками. Немаловажную роль в этом играют оптимальная домашняя кислородотерапия, обучение родителей и рутинный контроль сатурации кислорода [17].
Эпилепсия выявлена только у 2 наблюдавшихся детей, хотя в систематическом обзоре количество пациентов с эпилепсией превалирует (табл. 2), что, вероятно, связано с относительно коротким наблюдением наших пациентов (до 5 лет). В обзорах данной патологии указана необходимость ежегодного неврологического осмотра и инструментального обследования, включающего проведение ЭЭГ [18, 19]. Наши данные свидетельствуют о том, что в процессе диагностического поиска при необходимости визуализации лёгких посредством компьютерной томографии органов грудной клетки целесообразно выполнить исследование с внутривенным контрастированием сердца и магистральных сосудов, в том числе грудной аорты и сосудов шеи, с целью получения информации о размерах и степени извитости магистральных сосудов. Необходима оценка степени дилатации аорты, которая не всегда достаточно информативна при проведении ультразвукового исследования сердца и сосудов, хотя ЭхоКГ по-прежнему из-за доступности и отсутствия побочных эффектов является хорошим скрининговым инструментом наблюдения за детьми.
У всех 6 пациентов, включённых в наше исследование, были выявлены каузальные варианты гена FLNA с помощью технологии высокопроизводительного секвенирования, что подтверждает целесообразность внедрения данной технологии в рутинную лабораторную практику для экзомного секвенирования, секвенирования панелей генов, а также для секвенирования полной последовательности нуклеотидов отдельных генов, приводящих к развитию различных моногенных заболеваний — как редких [20], так и хорошо изученных [21].
Заключение
Заподозрить патологию, обусловленную патогенными вариантами в гене FLNA, следует при комбинации эмфизематозного заболевания лёгких, приводящего к ДН у младенцев с ВПС, дисплазией клапанов сердца, ЛГ, ПНГ и эпилепсией. Степень выраженности каждого нозологического проявления определяет маршрутизацию пациента по разным отделениям и стационарам, пока не обнаружится общая связь между заболеваниями у пациентов с патогенными вариантами в гене FLNA. Мультидисциплинарный подход у данной категории пациентов имеет решающее значение в постановке диагноза, лечении и реабилитации. Своевременное генетическое консультирование и обследование позволяют консолидировать усилия.
Список литературы
1. Sheen V.L., Jansen A., Chen M.H., Parrini E., Morgan T., Ravenscroft R., et al. Filamin A mutations cause periventricular heterotopia with Ehlers–Danlos syndrome. Neurology. 2005; 64(2): 254–62. https://doi.org/10.1212/01.WNL.0000149512.79621.DF
2. Zhang X., Chen M.H., Wu X., Kodani A., Fan J., Doan R., et al. Cell-type-specific alternative splicing governs cell fate in the developing cerebral cortex. Cell. 2016; 166(5): 1147–62.e15. https://doi.org/10.1016/j.cell.2016.07.025
3. Chen M., Walsh C., Adam M., Feldman J., Mirzaa G., Pagon R., et al. FLNA deficiency. In: GeneRewiews. Seattle; 1993.
4. Wade E., Halliday B., Jenkins A., O’Neill A., Robertson S. The X-linked filaminopathies: Synergistic insights from clinical and molecular analysis. Hum. Mutat. 2020; 41(5): 865–83. https://doi.org/10.1002/humu.24002
5. Guerrini R., Carrozzo R. Epileptogenic brain malformations: clinical presentation, malformative patterns and indications for genetic testing. Seizure. 2001; 10(7): 532–43. https://doi.org/10.1053/seiz.2001.0650
6. Sheen V.L., Dixon P.H., Fox J.W., Hong S.E., Kinton L., Sisodiya S.M., et al. Mutations in the X-linked filamin 1 gene cause periventricular nodular heterotopia in males as well as in females. Hum. Mol. Genet. 2001; 10(17): 1775–83. https://doi.org/10.1093/hmg/10.17.1775
7. Billon C., Adham S., Poblete H.N., Legrand A., Frank M., Chiche L., et al. Cardiovascular and connective tissue disorder features in FLNA-related PVNH patients: progress towards a refined delineation of this syndrome. Orphanet. J. Rare Dis. 2021; 16(1): 504. https://doi.org/10.1186/s13023-021-02128-1
8. Stourm L. Grynblat J. Savale L. Pulmonary hypertension in patients carrying FLNA loss-of-function variants. Eur. Resp. J. 2024; 64(Suppl. 68): PA1604. https://doi.org/10.1183/13993003.congress-2024.PA1604
9. Masurel-Paulet A., Haan E., Thompson E., Goizet C., Thauvin-Robinet C., Tai A., et al. Lung disease associated with periventricular nodular heterotopia and an FLNA mutation. Eur. J. Med. Genet. 2011; 54(1): 25–8. http://doi.org/10.1016/j.ejmg.2010.09.010
10. Burrage L.C., Guillerman R.P., Das S., Singh S., Schady D.A., Morris S.A., et al. Lung transplantation for FLNA-associated progressive lung disease. J. Pediatr. 2017: 186: 118-23.e6. https://doi.org/10.1016/j.jpeds.2017.03.045
11. Миклашевич И.М., Школьникова М.А., Горбачевский С.В., Шмальц А.А., Грознова О.С., Садыкова Д.И., и др. Современная стратегия терапии легочной гипертензии у детей. Кардиоваскулярная терапия и профилактика. 2018; 17(2): 101–24. https://doi.org/10.15829/1728-8800-2018-2-101-124 https://elibrary.ru/xmgtrz
12. Жесткова М.А., Мамаева Е.А., Овсянников Д.Ю. Заболевания, ассоциированные с мутациями в гене филамина А (FLNA). Российский вестник перинатологии и педиатрии. 2021; 66(3): 20–6. https://doi.org/10.21508/1027-4065-2021-66-3-20-26 https://elibrary.ru/ttpwgt
13. Овсянников Д.Ю., Котлукова Н.П., Тележникова Н.Д., Трунина И.И., Миклашевич И.М., Щербакова Н.В. и др. Заболевания, ассоциированные с мутациями в гене филамина А: трудный путь к диагнозу (два клинических наблюдения). Педиатрия им. Г.Н. Сперанского. 2022; 101(1): 202–8. https://doi.org/10.24110/0031-403X-2022-101-1-202-208 https://elibrary.ru/kuhqee
14. Рыжкова О.П., Кардымон О.Л., Прохорчук Е.Б., Коновалов Ф.А., Масленников А.Б., Степанов В.А. и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2). Медицинская генетика. 2019; 18(2): 3–23. https://doi.org/10.25557/2073-7998.2019.02.3-23 https://elibrary.ru/jzljue
15. Chin K., Gaine S., Gerges C., Jing Z., Mathai S., Tamura Y., et al. Treatment algorithm for pulmonary arterial hypertension. Eur. Respir. J. 2024; 64(4): 2401325. https://doi.org/10.1183/13993003.01325-2024
16. Del Cerro M.J., Abman S., Diaz G., Freudenthal A.H., Freudenthal F., Harikrishnan S., et al. A consensus approach to the classification of pediatric pulmonary hypertensive vascular disease: Report from the PVRI Pediatric Taskforce, Panama 2011. Pulm. Circ. 2011; 1(2): 286–98. https://doi.org/10.4103/2045-8932.83456
17. Беляшова М.А., Овсянников Д.Ю., Зайцева А.С., Даниэл-Абу М., Елисеева Т.И. Длительная домашняя кислородотерапия у детей: кому, когда, как? Педиатрия им. Г.Н. Сперанского. 2018; 97(6): 133–40. https://doi.org/10.24110/0031-403X-2018-97-6-133-140 https://elibrary.ru/yogfcp
18. Battaglia G., Chiapparini L., Franceschetti S., Freri E., Tassi L., Bassanini S., et al. Periventricular nodular heterotopia: classification, epileptic history, and genesis of epileptic discharges. Epilepsia. 2006; 47(1): 86–97. https://doi.org/10.1111/j.1528-1167.2006.00374.x
19. Lange M., Kasper B., Bohring A., Rutsch F., Kluger G., Hoffjan S., et al. 47 patients with FLNA associated periventricular nodular heterotopia. Orphanet J. Rare Dis. 2015; 10: 134. https://doi.org/10.1186/s13023_015_0331_9
20. Савостьянов К.В. Современные алгоритмы генетической диагностики редких наследственных болезней у российских пациентов. М.: Полиграфист и издатель; 2022. https://elibrary.ru/rduzgh
21. Баранов А.А., Капранов Н.И., Каширская Н.Ю., Намазова-Баранова Л.С., Шерман В.Д., Симонова О.И., и др. Проблемы диагностики муковисцидоза и пути их решения в России. Педиатрическая фармакология. 2014; 11(6): 16–23. https://elibrary.ru/tgiwut
Об авторах
Владимир Петрович МирошниченкоРоссия
Врач — детский кардиолог ГБУЗ Морозовская ДГКБ ДЗМ, 119049, Москва, Россия
e-mail: vmiroshnichenko@morozdgkb.ru
Дмитрий Юрьевич Овсянников
Россия
Доктор мед. наук, профессор, зав. кафедрой педиатрии РУДН, 117198, Москва, Россия
SPIN-код: 5249-5760
e-mail: mdovsyannikov@yahoo.com
Михаил Арамович Абрамян
Россия
Доктор мед. наук, профессор кафедры педиатрии РУДН, 117198, Москва, Россия; зав. отделением экстренной кардиохирургии и интервенционной кардиологии ГБУЗ Морозовская ДГКБ ДЗМ, 119049, Москва, Россия
e-mail: mdgkb@zdrav.mos.ru
Людмила Михайловна Кузенкова
Россия
Доктор мед. наук, профессор, врач-педиатр, врач-невролог, начальник центра детской психоневрологии, зав. отделением психоневрологии и психосоматической патологии ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
e-mail: kuzenkova@nczd.ru
Виктория Александровна Айсина
Россия
Мл. науч. сотр. лаб. инструментальной и лучевой диагностики, врач функциональной диагностики ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
e-mail: drvika68@gmail.com
Евгения Викторовна Бойцова
Россия
Доктор мед. наук, профессор кафедры пропедевтики детских болезней ФГБОУ ВО СПбГПМУ Минздрава России, 194100, Санкт-Петербург, Россия
e-mail: evboitsova@mail.ru
Шамиль Абдулвахидович Гитинов
Россия
Ассистент кафедры педиатрии РУДН, 117198, Москва, Россия
e-mail: dr.gitinov@mail.ru
Ольга Викторовна Гнеушева
Россия
Врач-педиатр паллиативного отделения ГБУЗ Морозовская ДГКБ ДЗМ, 119049, Москва, Россия
e-mail: gneusheva@zdrav.mos.ru
Александр Валерьевич Горбунов
Россия
Доктор мед. наук, профессор, врач-рентгенолог отделения лучевой диагностики ГБУЗ Морозовская ДГКБ ДЗМ, 119049, Москва, Россия, профессор кафедры неонатологии факультета дополнительного профессионального образования Института непрерывного образования и профессиональной переподготовки ФДПО ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), 119049, Москва, Россия
SPIN-код: 4463-5472
e-mail: agorbunov@morozdgkb.ru
Валерий Викторович Горев
Россия
Канд. мед. наук, гл. внештатный специалист неонатолог, гл. врач ГБУЗ Морозовская ДГКБ ДЗМ, 119049, Москва, Россия
SPIN-код: 8944-9664
e-mail: mdgkb@zdrav.mos.ru
Анна Валерьевна Иванова
Россия
Зав. педиатрическим отделением, пульмонолог, ГБУЗ ДОКБ, 170001, Тверь, Россия
e-mail: guz_dokb@mail.ru
Игорь Александрович Ковалев
Россия
Доктор мед. наук, профессор, президент Всероссийской общественной организации АДКР, советник директора ФГБУ НМИЦ ССХ им. А.Н. Бакулева Минздрава России, 121552, Москва, Россия; профессор кафедры госпитальной педиатрии № 2 ИМД ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), 119049, Москва, Россия
e-mail: Sekretariat@bakulev.ru
Ольга Борисовна Кондакова
Россия
Канд. мед. наук, врач-генетик высшей квалификационной категории, зав. отделением медицинской генетики ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
e-mail: kondakovao68@gmail.com
Наталия Павловна Котлукова
Россия
Доктор мед. наук, профессор кафедры педиатрии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), 119049, Москва, Россия
Надежда Ефимовна Кравченко
Россия
Канд. мед. наук, ст. науч. сотр. отдела по изучению проблем подростковой психиатрии ФГБНУ НЦПЗ Минобрнауки России, 115522, Москва, Россия
SPIN-код: 9357-1303
e-mail: kravchenkone@mail.ru
Алла Александровна Кузнецова
Россия
Доктор мед. наук, профессор кафедры факультетской педиатрии ФГБОУ ВО СПбГПМУ Минздрава России, 194100, Санкт-Петербург, Россия
e-mail: pediatr-kuznetsova@yandex.ru
Анастасия Андреевна Лялина
Россия
Клинический генетик, врач-невролог, отделения психоневрологии и нейрореабилитации ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
Ирина Михайловна Миклашевич
Россия
Канд. мед. наук, зав. детским кардиологическим отделением Научно-исследовательского клинического института педиатрии и детской хирургии имени академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), 125412, Москва, Россия
Светлана Ивановна Петрова
Россия
Канд. мед. наук, доцент кафедры факультетской педиатрии ФГБОУ ВО СПбГПМУ Минздрава России, 194100, Санкт-Петербург, Россия
Александр Алексеевич Пушков
Россия
Канд. биол. наук, ведущ. науч. сотр. лаб. молекулярной генетики и клеточной биологии ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
e-mail: pushkovgenetika@gmail.com
Ольга Игоревна Симонова
Россия
Доктор мед. наук, профессор, зав. пульмонологическим отделением, специалист лаборатории редких наследственных болезней у детей ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
e-mail: simonova_o_i@staff.sechenov.ru
Наталия Михайловна Соломатина
Россия
Педиатр, врач-пульмонолог педиатрического отделения № 2 ФГБОУ ВО СПбГПМУ Минздрава России, 194100, Санкт-Петербург, Россия
e-mail: tatasolo@icloud.com
Валерия Алексеевна Стрельникова
Россия
Ассистент кафедры педиатрии РУДН, 117198, Москва, Россия
SPIN-код: 2567-2850
e-mail: doc.strelnikova@mail.ru
Оксана Анатольевна Суетина
Россия
Канд. мед. наук, ст. науч. сотр. отдела по изучению проблем подростковой психиатрии ФГБНУ НЦПЗ, 115522, Москва, Россия
e-mail: oksanaanatolevna@yandex.ru
Наталия Дмитриевна Тележникова
Россия
Врач детский кардиолог отделения детской кардиологии ДГКБ им. З.А. Башляевой ДЗМ, 125373, Москва, Россия
e-mail: natalia-tel@mail.ru
Инна Игоревна Трунина
Россия
Доктор мед. наук, профессор кафедры госпитальной педиатрии № 1 педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет), 119049, Москва, Россия, зав. отделением, врач детский кардиолог ДГКБ им. З.А. Башляевой ДЗМ, 125373, Москва, Россия
e-mail: iitrunina@mail.ru
Кирилл Викторович Савостьянов
Россия
Доктор биологических наук, руководитель центра фундаментальных исследований в педиатрии, заведующий лаб. медицинской геномики ФГАУ «НМИЦ здоровья детей» Минздрава России, 119296, Москва, Россия
SPIN-код: 6377-3090
e-mail: savostyanovkv@nczd.ru
Рецензия
Для цитирования:
Мирошниченко В.П., Овсянников Д.Ю., Абрамян М.А., Кузенкова Л.М., Айсина В.А., Бойцова Е.В., Гитинов Ш.А., Гнеушева О.В., Горбунов А.В., Горев В.В., Иванова А.В., Ковалев И.А., Кондакова О.Б., Котлукова Н.П., Кравченко Н.Е., Кузнецова А.А., Лялина А.А., Миклашевич И.М., Петрова С.И., Пушков А.А., Симонова О.И., Соломатина Н.М., Стрельникова В.А., Суетина О.А., Тележникова Н.Д., Трунина И.И., Савостьянов К.В. Заболевание, обусловленное патогенными вариантами гена филамина А (FLNA): результаты многоцентрового исследования. Неврологический журнал имени Л.О. Бадаляна. 2025;6(2):72-84. https://doi.org/10.46563/2686-8997-2025-6-2-72-84. EDN: eacojw
For citation:
Miroshnichenko V.P., Ovsyannikov D.Yu., Abramyan M.A., Kuzenkova L.M., Aisyna V.A., Boytsova E.V., Gitinov Sh.A., Gneusheva O.V., Gorbunov A.V., Gorev V.V., Ivanova A.V., Kovalev I.A., Kondakova O.B., Kotlukova N.P., Kravchenko N.E., Kuznetsova A.A., Lyalina A.A., Miklashevich I.M., Petrova S.I., Pushkov A.A., Simonova O.I., Solomatina N.M., Strelnikova V.A., Suetina O.A., Telezhnikova N.D., Trunina I.I., Savostyanov K.V. Filamin A (FLNA) gene mutation-associated disease: results of a multicenter study. L.O. Badalyan Neurological Journal. 2025;6(2):72-84. (In Russ.) https://doi.org/10.46563/2686-8997-2025-6-2-72-84. EDN: eacojw




























